题目内容
【题目】根据下列反应所画图象正确的是
A | B | C | D |
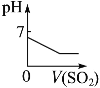
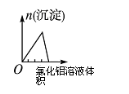
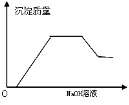
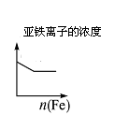
将二氧化硫通入到一定量氯水中 | 将氯化铝溶液滴入到一定量NaOH溶液中 | NaOH溶液加入AlCl3、Mg(NO3)2、HNO3溶液中 | 将铁粉加入到一 定量氯化铁溶液中 |
|
|
|
|
【答案】A
【解析】
试题分析:A、氯气溶于水生成盐酸和次氯酸,次氯酸是弱酸且氯气的溶解性较小,所以溶液的PH较大,当向氯水中通入二氧化硫时,氯水中的氯气具有强氧化性,在水溶液中能把二氧化硫氧化成硫酸,氯气和二氧化硫、水的反应方程式为 Cl2+SO2+2H2O=H2SO4+2HCl,所以溶液的酸性增强,PH值减小,最后达定值,故A正确;B、向NaOH溶液中滴加AlCl3溶液至过量,NaOH溶液中开始无沉淀(或出现白色沉淀后迅速溶解);继续滴加AlCl3溶液中产生沉淀达到最大值后保持不变。反应离子方程式:①Al3++4OH-=AlO2-+2H2O;②Al3++3AlO2-+6H2O=4Al(OH)3↓,故B错误;C、氢氧化钠先与硝酸反应,无沉淀生成,再与AlCl3、Mg(NO3)2反应,生成氢氧化镁沉淀和氢氧化铝沉淀,然后氢氧化铝沉淀溶解,图像存在一个最高点,故C错误;D、因Fe+2Fe3+═3Fe2+溶液中亚铁离子浓度逐渐增大,最后不变,故D错误;故选A。

练习册系列答案
相关题目