题目内容
下列有关叙述正确的是( )
| A.强电解质的饱和溶液一定是浓溶液 |
| B.凡是能导电的物质都是电解质 |
| C.氯气不是电解质,所以氯水不导电 |
| D.硫酸是强电解质 |
D
电解质研究的对象是化合物,故B错。氯气虽不是电解质,但溶于水后可与水反应生成HCl等电解质,能导电,C错。饱和溶液的浓度与溶质的溶解度有关,与电解质的强弱无关。有的强电解质在水中的溶解度较小,特别是难溶物,其饱和溶液的浓度较小,如Ca(OH)2、CaSO4溶液浓度较小;硫酸是强酸,在水中完全电离,属强电解质。

练习册系列答案
相关题目

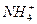 )=2.0×10-6 mol·L-1、C(Cl-)=3.5×10-6 mol·L-1、C(
)=2.0×10-6 mol·L-1、C(Cl-)=3.5×10-6 mol·L-1、C(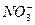 )=4.5×10-6 mol·L-1、C(
)=4.5×10-6 mol·L-1、C(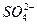 )=5.0×10-6 mol·L-1,则此雨水的pH约为( )
)=5.0×10-6 mol·L-1,则此雨水的pH约为( ) Na++HS-
Na++HS-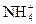 +
+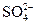
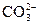
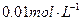 氢氧化钠的PH=11水的离子积常数KW是多少?
氢氧化钠的PH=11水的离子积常数KW是多少?