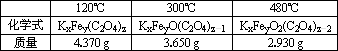题目内容
某草酸盐晶体KxFey(C2O4)z•wH2O中铁为+3价,草酸根为-2价,且知x+y+z=7。取该晶体做了以下实验:
① 取4.910g晶体在不同温度下加热至恒重,所得固体的化学式和质量如下表:
|
|
120℃ |
300℃ |
480℃ |
|
化学式 |
KxFey(C2O4)z |
KxFeyO(C2O4)z-1 |
KxFeyO2(C2O4)z-2 |
|
质量 |
4.370g |
3.650g |
2.930 g |
加热到300℃以上时,还生成了一种不常见的碳的氧化物气体(用R表示);
② 另取4.910g晶体,经过加酸溶解、加足量碱沉淀、灼烧至恒重,铁元素全部转化为Fe2O3,质量为0.800g。
(1)计算得出草酸盐晶体中结晶水的质量分数为 (保留三位小数);
(2)R的化学式为 ;
(3)草酸盐晶体的摩尔质量为 ;
(4)试通过计算,确定草酸盐晶体的化学式。
(1)11.0%或0.110(3分)
(2)C2O3(3分)
(3)491 (3分)
(4)K3Fe(C2O4)3•3H2O (7分)
【解析】
试题分析:(1)草酸盐晶体中结晶水的质量分数为:(4.910-4.370)*100%/4.910=11%
(2)300℃ KxFeyO(C2O4)z-1 ;480℃ KxFeyO2(C2O4)z-2 R:C2O3
(3)120℃ 4.370g KxFey(C2O4)z ; 300℃ 3.650g KxFeyO(C2O4)z-1
解:设KxFey(C2O4)z•wH2O的物质的量为n
KxFey(C2O4)z•wH2O→KxFey(C2O4)z→KxFeyO(C2O4)z-1→C2O3
1 1 72
n 4.370-3.650
n=0.01
M=m/n=4.910/0.01=491 (g/mol)
(4)2 KxFey(C2O4)z•wH2O→2KxFey(C2O4)z→2wH2O---------→yFe2O3
2 2 36w y
0.01 4.910-4.370=0.54 0.8/160
y=1 w=3 由因为x+y+z=7。
2KxFey(C2O4)z•wH2O→yFe2O3→2wH2O 铁为+3价,草酸根为-2价,且知x+y+z=7。
x+3y=2z y=1 代入 x+3=2z x+1+ z=7 x=3 z=3
化学式:K3Fe(C2O4)3•3H2O
考点:本题以实验为基础,考查化学计算等知识。

 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案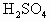 共热可产生气体B;将B的浓溶液与
共热可产生气体B;将B的浓溶液与 共热又能生成一种绿色气体C;如果将锌投入B稀溶液中生成气体D;C与D组成的混合气体经光照发生爆炸,又生成气体B,气体C可被NaOH溶液吸收生成A.
共热又能生成一种绿色气体C;如果将锌投入B稀溶液中生成气体D;C与D组成的混合气体经光照发生爆炸,又生成气体B,气体C可被NaOH溶液吸收生成A.