题目内容
【题目】二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
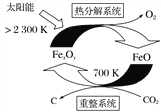
(1)科学家提出由CO2制取C的太阳能工艺如上图所示。
①若“重整系统”发生的反应中![]() =6,则FexOy的化学式为________。
=6,则FexOy的化学式为________。
②“热分解系统”中每分解1molFexOy,转移电子的物质的量为________。
⑵工业上用CO2和H2反应合成甲醚。已知:
CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1
CH3OCH3(g)+H2O(g)===2CH3OH(g) ΔH2=+23.4kJ·mol-1
则2CO2(g)+6H2(g)===CH3OCH3(g)+3H2O(g) ΔH3=________kJ·mol-1。
①一定条件下,上述合成甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是________(填字母)。
逆反应速率先增大后减小 b.H2的转化率增大
c.反应物的体积百分含量减小 d.容器中的![]() 值变小
值变小
②在某压强下,合成甲醚的反应在不同温度、不同投料比时,CO2的转化率如下图所示。T1温度下,将6molCO2和12molH2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=__________;KA、KB、KC三者之间的大小关系为____________。

(3)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中,c(NH![]() )________(填“>”、“<”或“=”)c(HCO
)________(填“>”、“<”或“=”)c(HCO![]() );反应NH
);反应NH![]() +HCO
+HCO![]() +H2ONH3·H2O+H2CO3的平衡常数K=__________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11)
+H2ONH3·H2O+H2CO3的平衡常数K=__________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11)
【答案】⑴①Fe3O4 2mol
⑵-130.8 ①b ②0.18mol·L-1·min-1 KA=KC>KB
⑶> 1.25×10-3
【解析】(1)①由示意图可知,重整系统中CO2和FeO反应生成FexOy和C,发生的反应中n(FeO)/n(CO2) =6,根据Fe原子、O原子守恒可知x:y=6:(6+2)=3:4,故FexOy的化学式为Fe3O4;②“热分解系统”中分解的方程式为2Fe3O4=6FeO+O2↑,每分解1molFe3O4生成0.5mol氧气,转移电子的物质的量为0.5mol×4=2mol;已知:①CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1,②CH3OCH3(g)+H2O(g)===2CH3OH(g) ΔH2=+23.4kJ·mol-1,根据盖斯定律,①×2-②可得:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) ΔH3=-130.8kJ·mol-1。(2)①a.逆反应速率先增大后减小,可能是增大生成物浓度,平衡逆向移动,错误;b.氢气的转化率增大,平衡一定正向移动,正确;c.反应物的体积百分含量减小,可能是增大生成物浓度,平衡逆向移动,错误;d.容器中的n(CO2)/n(H2)变小,可能是减小二氧化碳物质的量,平衡逆向移动,错误;答案选b。②T1温度下,将6molCO2和12molH2充入2L的密闭容器中,由图象可知,5min后反应达到平衡状态时二氧化碳转化率为60%,则生成CH3OCH3为6mol×60%×1/2=1.8mol,所以平均反应速率v(CH3OCH3)=1.8mol÷(2L×5min) =0.18molL-1min-1;③反应为放热反应,升高温度平衡向逆反应方向进行,转化率降低,因此T1<T2,而平衡常数只与温度有关系,则KA、KB、KC三者之间的大小关系为KA=KC>KB ;(3)根据盐类水解规律,已知NH3·H2O的电离平衡常数K=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11,所以碳酸氢根的水解程度更大,因此c(NH4+) >c(HCO3-);反应NH4++HCO3-+H2O=NH3·H2O+H2CO3的平衡常数K=c(NH3H2O)c(H2CO3) /c(NH4+)c(HCO3)=c(H+)c(OH)/K(NH3H2O)K1 =![]() =1.25×10-3。
=1.25×10-3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】观察下列模型并结合有关信息进行判断,下列说法错误的是
HCN | S8 | |
结构模型示意图 |
|
|
备注 | - | 易溶于CS2 |
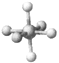
SF6 | B12结构单元 | |
结构模型示意图 |
|
|
备注 | - | 熔点1873K |
A. HCN的结构式为H—C≡N
B. 固态硫S8属于原子晶体
C. SF6是由极性键构成的非极性分子
D. 单质硼属原子晶体,结构单元中含有30个B—B键,含20个正三角形