题目内容
8.现有氧化铁和氧化铜的混合物mg,加入2.5mol/L的硫酸溶液40mL时,恰好完全溶解.若将2mg这种混合物在氢气流中加热并充分反应,冷却后剩余固体的质量为( )| A. | 0.8g | B. | 1.6mg | C. | (2m-3.2g) | D. | (2m-1.6)g |
分析 氧化铁和氧化铜的混合物与硫酸反应是硫酸盐与水,由于硫酸中H元素与混合物中O元素结合生成水,则混合物中n(O)=n(H2SO4),进而计算2mg该混合物中O元素质量,将2mg这种混合物在氢气流中加热并充分反应,冷却后剩余固体为Fe、Cu,金属质量=氧化物质量-氧元素质量.
解答 解:氧化铁和氧化铜的混合物与硫酸反应是硫酸盐与水,由于硫酸中H元素与混合物中O元素结合生成水,则混合物中n(O)=n(H2SO4)=0.04L×2.5mol/L=0.1mol,故2mg该混合物中O元素质量为:0.1mol×2×16g/mol=3.2g,
若将2mg这种混合物在氢气流中加热并充分反应,冷却后剩余固体为Fe、Cu,则固体质量为:2:mg-3.2g=(2m-3.2)g,
故选C.
点评 本题考查混合物的计算,题目难度中等,注意根据硫酸中H元素与混合物中O元素结合生成水确定混合物中氧元素物质的量,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.由下列实验事实所得出的相应结论的因果关系正确的是( )
| 实验事实 | 结论 | |
| A | KClO3和SO3溶于水后能导电 | KClO3和SO3为电解质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | 将CO2通入NaAlO2溶液会产生白色沉淀 | 结合H+的能力:HCO${\;}_{3}^{-}$<AlO${\;}_{2}^{-}$ |
| D | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
| A. | A | B. | B | C. | C | D. | D |
20.常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是( )
| A. | 澄清透明的溶液中:Cu2+、Fe3+、NO3-、Cl- | |
| B. | 使甲基橙变红色的溶液:Fe2+、K+、NO3-、SO42- | |
| C. | 含有大量ClO-的溶液中:K+、OH-、I-、SO32- | |
| D. | 由水电离产生的c(H+)=10-12mol•L-1的溶液:NH4+、SO42-、HCO3-、Cl- |
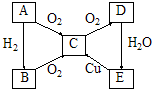 A,B,C,D,E五种物质可按图所示发生转变(反应条件已略去).
A,B,C,D,E五种物质可按图所示发生转变(反应条件已略去).
 如图是一个原电池装置,请按要求填空.
如图是一个原电池装置,请按要求填空.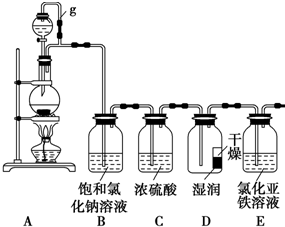 某探究小组为探究氯气的性质,设计了如下实验装置.请回答下列问题:
某探究小组为探究氯气的性质,设计了如下实验装置.请回答下列问题: 某同学欲配制4mol•L-l的硫酸,但实验室只有三种不同浓度的硫酸:
某同学欲配制4mol•L-l的硫酸,但实验室只有三种不同浓度的硫酸: