题目内容
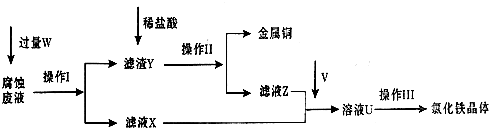
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下,请回答下列问题:
(1)请写出FeCl3溶液与铜反应的离子方程式:______;操作Ⅰ加入的试剂W是______.
(2)操作Ⅱ之前最好加入适量稀盐酸,某同学用10mol-L-1 的浓盐酸配制250mL 1mol-L-1 的稀盐酸,并进行有关实验.
①需要量取浓盐酸______mL.
②配制该稀盐酸时除量筒、烧杯、玻璃棒外,还必须用到的仪器有______、______.
③用已知浓度的氢氧化钠溶液滴定稀盐酸,滴定过程中眼睛应注视______,实验时未用标准液润洗滴定管,测得锥形瓶中待测液的浓度______实际浓度.(填“>”、“<”或“=”).
(3)操作Ⅲ前需要通入气体V,请写出实验室制取气体V的化学方程式:______,该反应中______是氧化剂.
(4)操作Ⅲ应在HCl气流氛围中进行,其原因是______.
(5)若通入的V的量不足,则最后制得的氯化铁晶体不纯净,这是因为溶液U中含有杂质______.请设计合理的实验,验证溶液U中的成分,并判断通入的V的量是否不足______(简要说明实验步骤、现象和结论).
供选择的试剂:酸性KMnO4溶液、KSCN溶液、氯水.
(6)若向氯化铁溶液中加入一定量石灰水,调节溶液pH,可得红褐色沉淀.该过程中调节溶液的pH为5,则金属离子浓度为______.(己知:Ksp[Fe(OH)3]=4.0×10-38)

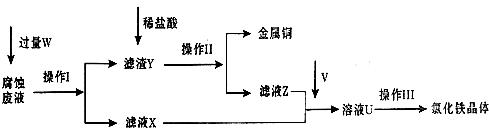
(1)请写出FeCl3溶液与铜反应的离子方程式:______;操作Ⅰ加入的试剂W是______.
(2)操作Ⅱ之前最好加入适量稀盐酸,某同学用10mol-L-1 的浓盐酸配制250mL 1mol-L-1 的稀盐酸,并进行有关实验.
①需要量取浓盐酸______mL.
②配制该稀盐酸时除量筒、烧杯、玻璃棒外,还必须用到的仪器有______、______.
③用已知浓度的氢氧化钠溶液滴定稀盐酸,滴定过程中眼睛应注视______,实验时未用标准液润洗滴定管,测得锥形瓶中待测液的浓度______实际浓度.(填“>”、“<”或“=”).
(3)操作Ⅲ前需要通入气体V,请写出实验室制取气体V的化学方程式:______,该反应中______是氧化剂.
(4)操作Ⅲ应在HCl气流氛围中进行,其原因是______.
(5)若通入的V的量不足,则最后制得的氯化铁晶体不纯净,这是因为溶液U中含有杂质______.请设计合理的实验,验证溶液U中的成分,并判断通入的V的量是否不足______(简要说明实验步骤、现象和结论).
供选择的试剂:酸性KMnO4溶液、KSCN溶液、氯水.
(6)若向氯化铁溶液中加入一定量石灰水,调节溶液pH,可得红褐色沉淀.该过程中调节溶液的pH为5,则金属离子浓度为______.(己知:Ksp[Fe(OH)3]=4.0×10-38)
(1)FeCl3溶液与铜反应的离子方程式为:2Fe3++Cu═2Fe2++Cu2+,金属铁可以讲金属铜从其盐中置换出来,所以加的W是铁粉或Fe,故答案为:2Fe3++Cu═2Fe2++Cu2+;铁粉或Fe;
(2)①用10mol?L-1 的浓盐酸配制250mL 1mol?L-1 的稀盐酸,稀释前后溶质的物质的量不变,这所需浓盐酸的体积是V,则V?10mol?L-1=250mL?1mol?L-1,解得V=25mL,故答案为:25mL;
②配制一定物质的量浓度的溶液所需的玻璃仪器有:量筒、烧杯、玻璃棒、250mL容量瓶、胶头滴管,故答案为:250mL容量瓶、胶头滴管;
③用已知浓度的氢氧化钠溶液滴定稀盐酸,滴定过程中眼睛应注视锥形瓶内溶液颜色的变化,未用标准液润洗滴定管,相当于将标准液稀释,所需标准液的体积增多,所以测得锥形瓶中待测液的浓度大于实际浓度,故答案为:锥形瓶内溶液颜色的变化;大于;
(3)实验室制氯气的化学方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,izhongMn的化合价降低,所以二氧化锰是氧化剂,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;MnO2;
(4)三价铁离子易水解,氯化铁溶液蒸干得不到氯化铁晶体,所以需要加入酸来抑制铁离子水解,故答案为:抑制Fe3+(或FeCl3)的水解;
(5)若通入的氯气的量不足,亚铁离子不会完全被氧化为三价铁离子,所以最后制得的氯化铁晶体不纯净,会含有氯化亚铁,亚铁离子具有还原性,可以是高锰酸钾褪色,三价铁离子能使硫氰酸钾变为红色,可以据此来检验,
故答案为:FeCl2或Fe2+,;取少量溶液U,加入几滴KSCN溶液,溶液显红色,则表明溶液U中有Fe3+(FeCl3);另取少量溶液U,加入几滴酸性KMnO4溶液,若KMnO4溶液退色,则表明溶液U中有Fe2+(或FeCl2),说明通入的氯气的量不足够,若KMnO4溶液不退色,则说明通入的氯气的量充足;
(6)根据氢氧化铁的Ksp表达式:Ksp=[Fe3+][[OH-]3],溶液的pH为5即[H+]=10-5mol/L,所以金属铁离子浓度为4.0×10-11 mol?L-1,故答案为:4.0×10-11mol?L-1.
(2)①用10mol?L-1 的浓盐酸配制250mL 1mol?L-1 的稀盐酸,稀释前后溶质的物质的量不变,这所需浓盐酸的体积是V,则V?10mol?L-1=250mL?1mol?L-1,解得V=25mL,故答案为:25mL;
②配制一定物质的量浓度的溶液所需的玻璃仪器有:量筒、烧杯、玻璃棒、250mL容量瓶、胶头滴管,故答案为:250mL容量瓶、胶头滴管;
③用已知浓度的氢氧化钠溶液滴定稀盐酸,滴定过程中眼睛应注视锥形瓶内溶液颜色的变化,未用标准液润洗滴定管,相当于将标准液稀释,所需标准液的体积增多,所以测得锥形瓶中待测液的浓度大于实际浓度,故答案为:锥形瓶内溶液颜色的变化;大于;
(3)实验室制氯气的化学方程式为:MnO2+4HCl(浓)
| ||
| ||
(4)三价铁离子易水解,氯化铁溶液蒸干得不到氯化铁晶体,所以需要加入酸来抑制铁离子水解,故答案为:抑制Fe3+(或FeCl3)的水解;
(5)若通入的氯气的量不足,亚铁离子不会完全被氧化为三价铁离子,所以最后制得的氯化铁晶体不纯净,会含有氯化亚铁,亚铁离子具有还原性,可以是高锰酸钾褪色,三价铁离子能使硫氰酸钾变为红色,可以据此来检验,
故答案为:FeCl2或Fe2+,;取少量溶液U,加入几滴KSCN溶液,溶液显红色,则表明溶液U中有Fe3+(FeCl3);另取少量溶液U,加入几滴酸性KMnO4溶液,若KMnO4溶液退色,则表明溶液U中有Fe2+(或FeCl2),说明通入的氯气的量不足够,若KMnO4溶液不退色,则说明通入的氯气的量充足;
(6)根据氢氧化铁的Ksp表达式:Ksp=[Fe3+][[OH-]3],溶液的pH为5即[H+]=10-5mol/L,所以金属铁离子浓度为4.0×10-11 mol?L-1,故答案为:4.0×10-11mol?L-1.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目