题目内容
某化学研究性学习小组拟对一种焰火原料(由两种短周期的常见金属单质组成的合金粉末)进行探究。请完成下列探究报告。
【探究目的】探究该焰火原料的组成
【资料检索】①Mg2+检验方法:取2滴待检液,加入2滴2mol·L-1NaOH溶液,再加入1滴镁试剂(Ⅰ)染料(对硝基苯偶氮苯二酚)。若出现沉淀并吸附镁试剂(Ⅰ)染料呈天蓝色,表示待检液中含有Mg2+。Ag+、Cu2+、Fe3+、NH4+会妨碍Mg2+检出
②Mg(OH)2可溶于浓的氯化铵溶液,其他的常见不溶碱难溶于氯化铵
③很多合金是金属互化物,有确定的化学组成
【探究思路】①确定焰火原料所含金属种类;②测定焰火原料的化学式
【实验探究】
(1)甲同学进行了初步试验,实验步骤和实验现象如下。请填写下表。
| 试验序号 | 实 验 步 骤 | 实 验 现 象 | 结 论 |
| ① | 取少量该焰火原料加入冷水 | 无明显现象 | ________________ |
| ② | 取少量该焰火原料加入稀盐酸 | 完全溶解,有大量气体 | _________________ |
(2)乙同学取甲第②组实验的溶液,加入镁试剂(Ⅰ)染料,得出合金中不含镁。
乙的结论________________(选填“正确”或“错误”)。判断理由为
(3)丙同学设计实验方案,确定焰火原料中的金属种类,实验记录如下。
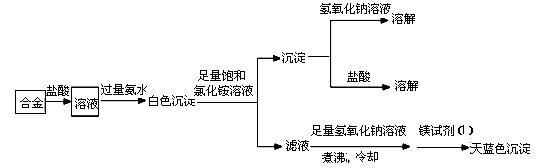
由丙的实验记录可知,该焰火原料是由_______和_________两种金属组成的合金;实验中滤液加入足量
氢氧化钠溶液后需煮沸,煮沸的理由是______________________________。
(4)丁同学利用丙同学的结论,设计如下图所示的实验步骤,确定合金组成。
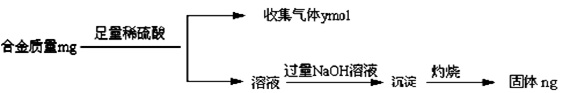
问题讨论:
①能确定合金组成的数据组有______________(填写选项字母);
A.m、n B.m、y C.n、y
②若合金中相对原子质量较小的金属的物质的量分数为x,金属总物质的量为7mol,试在下图中作出y随x变化的曲线;
③当y=8.5mol时,该合金是一种金属互化物,其化学式为________________
(1)①不含锂(Li)、钠(Na)等活泼金属
②可能含铍(Be)、镁(Mg)、铝(Al)三种金属中的任意两种金属
(2)错误;由资料知,反应必须在碱性条件下进行
(3)铝(或Al);镁(或Mg)(顺序可互换);将NH4+转化为NH3,煮沸促进其逸出,防止NH4+干扰Mg2+检验
(4)①ABC
②见下图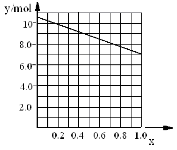
③Mg4Al3
解析试题分析:(1)①原料加入冷水无现象表明不含Li、Na等活泼金属;
②原料与盐酸反应产生气体表明含有能与盐酸反应的较活泼的金属,例如铍(Be)、镁(Mg)、铝(Al)三种金属中的任意两种金属。
(2)第②组实验所得的溶液含有过量盐酸,加入2滴NaOH溶液则不会产生沉淀,从而不能吸附镁试剂(I)染料呈天蓝色,所以不能检验不出Mg2+,要检验镁离子反应需要在解析条件下完成。
(3)合金能溶于盐酸,其溶液中滴加氨水生成白色沉淀。向白色沉淀中滴加过量的饱和氯化铵溶液,白色沉淀部分溶解,且剩余的白色沉淀既能和氢氧化钠溶液反应,也能和盐酸反应。因此根据Mg(OH)2可溶于浓的氯化铵溶液可知,该白色沉淀一定是由氢氧化镁和氢氧化铝组成的。由于Mg(OH)2可溶于浓的氯化铵溶液,因此用镁试剂(Ⅰ)染料检验Mg2+时要排除NH4+的干扰,所以滤液加入足量氢氧化钠溶液将NH4+转化为NH3,煮沸将氨气赶出,目的是防止NH4+干扰Mg2+的检验(或排除溶液中NH4+的干扰)。(4)①镁和铝都能与盐酸反应生成氢气,根据氢气的体积结合合金总质量可确定合金的组成。加入过量氢氧化钠得到的沉淀为氢氧化镁,灼烧后可得到氧化镁,根据氧化镁的质量可知镁的质量,则可知铝的质量,已知镁的质量和镁铝生成氢气的体积可知铝的质量,则A、B、C都可测定合金的组成,故答案为:A、B、C。
②若合金中相对原子质量较小的金属的物质的量分数为x,金属总物质的量为7mol,相对分子质量较小的为镁。若x=0,则全被为铝,7mol铝反应生成10.5mol氢气;如全被为镁,即x=7,则生成氢气7mol,所以图象为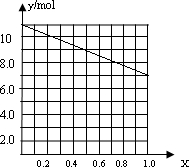 。
。
③设合金中镁和铝的物质的量分别是a和b,则a+b=7mol、a+1.5b=8.5mol,解得a=4mol、b=3mol,所以合金的组成是Mg4Al3。
考点:考查物质含量的测定、实验方案的设计与评价、物质检验以及数据、图像分析等

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,该晶体具有Na2CO3和H2O2的双重性质。利用图-2装置制备过碳酸钠,在冷水浴中充分反应后,按图-1流程可获得过碳酸钠产品。

(1)恒压滴液漏斗中支管的作用是 。
(2)制备过碳酸钠的关键是 。
(3)如果配制过碳酸钠的水中含有铁离子,不仅会削弱洗涤剂的去污能力,甚至完全失去杀菌作用。试分析其中的原因(写出其中一种即可,用方程式表示)。________________________________;
(4)某化学学习小组为了定性探究铁离子对这种新型漂白剂的不良影响,取该漂白剂100mL,加入25g FeCl3固体,产生大量无色无味气体,用贮气瓶收集气体。请选用下列试剂和实验用品完成气体成分的探究过程:0.1mol/LNaOH溶液、8.0mol/LNaOH溶液、澄清石灰水、0.01mol/LKMnO4溶液、BaCl2稀溶液、品红溶液、蒸馏水、木条、酒精灯、火柴、洗气瓶。
①提出假设:对该气体成分提出合理假设。
假设1:气体是O2; 假设2:气体是______________; 假设3:气体是CO2。
②设计方案:设计实验方案证明你的假设,在下表中完成实验步骤、预期现象与结论:
| 实验步骤 | 预期现象与结论 |
| 将气体依次通入盛有_______、________的洗气瓶中,________________________。 | ①________________________ ②________________________ ③________________________ |
下列是实验操作与预期实验目的或所得实验结论,正确的填(√)错误的填(×)
| 选项 | 实验操作 | 实验目的或结论 | 判断 |
| ① | 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 说明该钾盐是 | |
| ② | 向某溶液中加入盐酸,无明显现象,再向其中加入BaCl2溶液有白色淀沉淀产生 | 证明该溶液中有 SO42— | |
| ③ | 向淀粉溶液中加入一定量的稀硫酸加热,再加入一定量的新制氢氧化铜加热。 | 证明淀粉水解产生葡萄糖 | |
| ④ |  与浓硫酸170℃共热,制得的气体通人酸性 与浓硫酸170℃共热,制得的气体通人酸性 溶液 溶液 | 检验制得气体是否为乙烯 | |










