题目内容
海洋是个巨大的资源宝库,利用海水可制取许多化工产品。
(1)氯碱工业是以电解食盐水为基础化学工业,写出电解食盐水的化学方程式___________________________________________________________________.
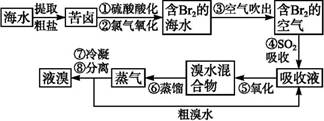
(2)从海水中提取溴常用吹出法,即用氯气(Cl2)将海水里溴化钠(NaBr)中的溴置换出来,再用空气吹出溴(Br2)。流程示意图如下: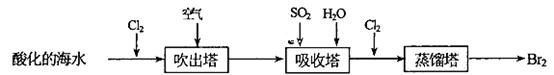
①写出氯气从NaBr中置换出溴单质的化学方程式:____________________;该反应在pH=3的酸性条件下进行,可用________测定反应液的酸碱度。
②吹出的溴和大量空气混合在—起进入吸收塔,根据流程图分析,通入SO2和水的目的是。_____________________________________________________.(用化学方程式表示)
(1) 2NaCl+2H2O Cl2↑+H2 ↑+2NaOH
Cl2↑+H2 ↑+2NaOH
(2)①Cl2+2NaBr=2NaCl+Br2 PH试纸
②Br2+S02+2H20═H2S04+2HBr
解析试题分析:
(1) 2NaCl+2H2O Cl2↑+H2 ↑+2NaOH
Cl2↑+H2 ↑+2NaOH
(2)①依据题干叙述可知氯气和溴化钠可以置换出溴单质,反应物是氯气和溴化钠,生成物是氯化钠和溴,根据观察法配平即可,其化学方程式为:Cl2+2NaBr=2NaCl+Br2,常见的测定溶液酸碱度的方法是使用pH试纸测定溶液的酸碱度。
②由于吸收塔中发生的反应是Br2+S02+2H20═H2S04+2HBr所以加入二氧化硫的目的是使溴与空气相互分离;
考点:海水提溴,涉及到海水中杂质的除掉方法和原理。

 阅读快车系列答案
阅读快车系列答案有一无色透明溶液,欲确定是否含有下列离子: Fe2+、Mg2+、Al3+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液进行实验:
| 实验步骤 | 实验现象 |
| (1)取少量该溶液,加几滴紫色石蕊试液 | 溶液变红 |
| (2)取少量该溶液加热,加Cu片和浓H2SO4,加热 | 有无色气体产生,气体遇空气变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀 |
| (4)取(3)中上层清液,加AgNO3溶液 | 有白色沉淀,且不溶于稀HNO3 |
| (5)取少量该溶液,加NaOH溶液 | 有白色沉淀,NaOH过量时沉淀部分溶解 |
由此判断:
(1)溶液中肯定不存在的离子有________,溶液中肯定存在的离子是____。
(2)请设计实验验证其中可能存在的阴离子的方法(写明操作、现象、结论)_____。
工业利用精炼镁渣(含有MgO、KCl、MgCl2、BaCl2、CaCl2、FeCl3等杂质)回收MgCl2的工业流程如下:
已知:25 ℃时有关物质的溶度积如下:
| 物质 | CaCO3 | MgCO3 | BaCO3 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 5.1×10-9 | 5.61×10-12 | 2.64×10-38 |
(1)写出溶解时的离子方程式 。
(2)溶解时温度不能太高,也不宜太低,要求控制在35 ℃左右,其理由是 。
(3)操作Ⅰ包含多个操作,分别为 ,过滤,洗涤,烘干。烘干时需要减压烘干,原因是 。
(4)为减少Na2CO3的用量和提高产品质量,在中和工序(中和后溶液接近中性)结束前要检验溶液中是否存在 离子,选择检验该离子的原因是 。
(5)母液的主要成分 。
苯甲酸广泛应用于制药和化工行业。某化学小组用甲苯作主要原料制备苯甲酸,反应过程如下: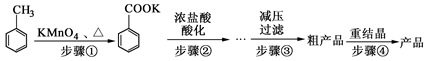
甲苯、苯甲酸钾、苯甲酸的部分物理性质见下表:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 在水中溶解性 |
| 甲苯 | -95 | 110.6 | 0.8669 | 难溶 |
| 苯甲酸钾 | 121.5~123.5 |  |  | 易溶 |
| 苯甲酸 | 122.4 | 248 | 1.2659 | 微溶 |
(1)将步骤①得到混合物加少量水,分离有机相和水相。有机相在 (填“上”或“下”)层;实验操作的名称是 。
(2)步骤②用浓盐酸酸化的目的是 。
(3)减压过滤装置所包含的仪器除减压系统外,还有 、 (填仪器名称)。
(4)已知温度越低苯甲酸的溶解度越小,但为了得到更多的苯甲酸晶体,重结晶时并非温度越低越好,理由是 。
(5)重结晶时需要趁热过滤,目的是 。
利用含锰废水(主要含Mn2+、SO42-、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工业流程如下:
已知某些物质完全沉淀的pH值如下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Mn(OH)2 | CuS | MnS | MnCO3 |
| 沉淀完全时的PH | 3.7 | 5.2 | 6.4 | 9.8 | ≥0 | ≥7 | ≥7 |
(1)若下列物质均能把Fe2+氧化为Fe3+,则过程①中可选择加入的氧化剂是 。
a.Cl2 b.MnO2 c.浓HNO3 d.H2O2
(2)过程②中,所得滤渣的成分是 。
(3)过程③中,搅拌的目的是 ,发生反应的离子方程式是 。
(4)过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3反应的离子方程式是___________。
(5)由MnCO3可制得重要的催化剂MnO2,MnCO3 +
 O2 → MnO2 + CO2。
O2 → MnO2 + CO2。现在空气中加热 460.0 g的MnCO3,得到332.0 g产品,若产品中杂质只有MnO,则该产品中MnO2的质量分数是 。(摩尔质量/g·:MnCO3 115 MnO2 87 MnO 71)