题目内容
【题目】下列叙述正确的是

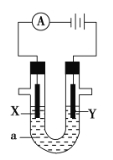
A. 图I装置中通入N2和O2的作用是相同的
B. 图Ⅱ中甲、乙两装置产生喷泉的原理一样
C. 图Ⅲ①装置中镁片是原电池的负极;②装置中镁片是原电池的正极
D. 图Ⅳ分液漏斗盛硝酸能证明非金属性N>C>Si,盛硫酸能证明非金属性S>C>Si
【答案】C
【解析】试题分析: 图I装置为Zn-Fe原电池,发生的是Zn的吸氧腐蚀,所以通入O2在正极发生还原反应,而通入的N2在负极不反应,起到加快反应速率的作用,A错误;图Ⅱ中甲、乙两装置产生喷泉的原理不一样,甲利用的是氨气的极易溶于水的性质,乙利用的是双氧水易分解产生氧气的性质,B错误;图Ⅲ①装置中Mg-Al构成原电池,二者都能与硫酸反应,由于镁比铝更活泼,所以镁片是原电池的负极;②装置中Mg-Al构成原电池,但能与氢氧化钠溶液反应的是铝,所以镁片是原电池的正极,C正确;图Ⅳ分液漏斗盛硝酸不能证明非金属性N>C>Si,因为硝酸是挥发性的酸,中间若没有除杂装置,容易对实验产生干扰,所以D错误;故选C。

【题目】如图所示,在元素周期表中处于A,B位置的某些元素性质相似,这称为“对角线规则”.下列有关4号元素铍的性质的推断正确的是( )
A | |
B |
A.铍能与冷水发生剧烈反应
B.氢氧化铍既能与强酸溶液反应,又能与强碱溶液反应
C.氢氧化铍的化学式为Be(OH)3
D.氧化铍只溶于强酸溶液,不溶于强碱溶液
【题目】(12分)中和热的测定是高中重要的定量实验。取0.55 mol/L的NaOH溶液50 mL与0.50 mol/L的盐酸50 mL置于图所示的装置中进行中和热的测定实验,回答下列问题
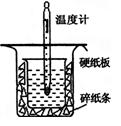
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是_________ _,除此之外,装置中的一个明显错误是 。
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热数值会_________,(填“偏大”、“偏小”或“不变”)。
(3)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所求中和热 (填“相等”或“不相等”),简述理由: 。
(4)某实验小组用盐酸和氢氧化钠溶液做了三次实验,每次取溶液各50 mL,并记录下原始数据:
实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
2 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
3 | 25.1 | 25.1 | 25.1 | 27.1 | 2.0 |
已知盐酸、NaOH溶液密度近似为1.00 g/cm3,中和后混合液的比热容c=4.18×10-3 kJ/(g·℃),根据计算结果,写出该中和反应的热化学方程式 。