题目内容
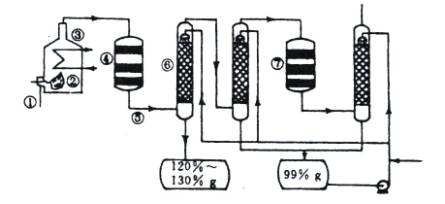
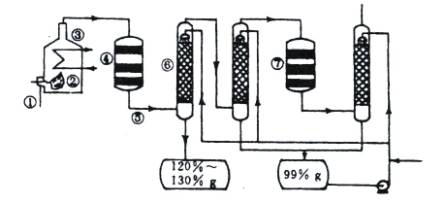
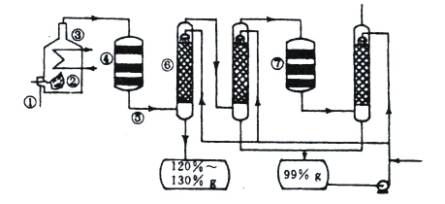
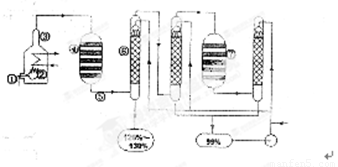
图1-1是现今常规的生产发烟硫酸和硫酸的流程简图。试回答: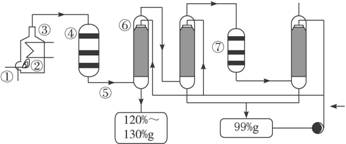
图1-1
(1)在①处投入的液态原料是什么?_______________________
(2)在②处发生1 500 ℃的不完全燃烧,即先混入少量的干燥空气,然后再在③处于700 ℃下再发生继续燃烧。为何这种燃烧方式对环境保护是有利的?_______________________
(3)在④处SO2被催化氧化成SO3,为使SO3的产率高,该处应取等温过程还是绝热过程为宜?_____________________________________________________________________
(4)为何二次催化炉⑦是必需的?_______________________
(5)⑤处的气体混合物主要是N2和SO3,为什么气体混合物通过吸收塔⑥后不立即通入二次催化炉?
_____________________________________________________________________
思路解析:先思考一下,在①处投入原料是什么?由于它是一种液态的原料,不可能是硫铁矿,生产硫酸还可以以硫为原料,硫的熔点不是很高,可在加热时形成液体。液态硫的温度较高,与空气混合后反应生成SO2,如在靠近进口处有大量的空气,会产生大量的SO2,逸散到空气中,对空气造成污染。SO2的催化氧化过程是一个气体体积减小、放热的可逆反应,升温不利于提高SO3的产率,因此在④处可采用等温过程。可逆反应的特点是转化率不可能达到100%,二次催化炉⑦是必需的,可将未反应的SO2继续反应氧化,使原料的利用率提高。在吸收塔⑥处中SO3被浓硫酸吸收,由于SO3的浓度大,主要得到120%—130%发烟硫酸。一部分未被吸收的SO3进入下一个吸收塔,得到99%的硫酸。通过两次吸收后,SO3几乎被完全吸收。
答案:(1)硫磺。
(2)如在靠近进口处有大量的空气,会产生大量的SO2,逸散到空气中,对空气造成污染。
(3)采用等温过程。
(4)可使原料的利用率提高。
(5)通过两次吸收后,SO3几乎被完全吸收。