题目内容
火法炼铜可以从黄铜矿(CuFeS2)或辉铜矿(Cu2S)中提取铜,发生如下反应:
①2CuFeS2+4O2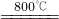 Cu2S+3SO2+2FeO
Cu2S+3SO2+2FeO
②2Cu2S+3O2 2Cu2O+2SO2
2Cu2O+2SO2
③2Cu2O+Cu2S 6Cu+SO2↑
6Cu+SO2↑
下列说法正确的是
- A.反应②、③中,Cu2S都只做还原剂
- B.1mol CuFeS2生成1molCu,理论上消耗2.5mol O2
- C.1mol Cu2S和O2反应生成2molCu转移的电子数为4mol
- D.反应①中,共转移的电子数为16mol,CuFeS2中铜元素的化合价为+2
B
分析:A.②中S元素的化合价升高,O元素的化合价降低;③中,Cu2S中Cu元素的化合价降低,S元素的化合价升高;
B.由反应可知,存在6Cu~3Cu2S~6CuFeS2~15O2,以此分析;
C.Cu元素由+1价降低为0,O元素的化合价降低,而S元素的化合价由-2价升高为+4价;
D.反应①中,Cu元素的化合价降低,O元素的化合价降低,S元素的化合价升高.
解答:A.②中S元素的化合价升高,O元素的化合价降低,Cu2S只做还原剂;③中,Cu2S中Cu元素的化合价降低,S元素的化合价升高,Cu2S既是还原剂又是氧化剂,故A错误;
B.由反应可知,存在6Cu~3Cu2S~6CuFeS2~15O2,则1mol CuFeS2生成1molCu,理论上消耗2.5molO2,故B正确;
C.Cu元素由+1价降低为0,O元素的化合价降低,而S元素的化合价由-2价升高为+4价,则转移的电子数为1mol×[4-(-2)]=6mol,故C错误;
D.反应①中,CuFeS2中铜元素的化合价为+2,Cu元素的化合价降低,O元素的化合价降低,S元素的化合价由-2价升高为+4价,2molCuFeS2反应转移电子为24mol,故D错误;
故选B.
点评:本题考查氧化还原反应及计算,明确反应中的元素的化合价变化是解答本题的关键,注意电子守恒、原子守恒的应用,选项D为易错点,题目难度较大.
分析:A.②中S元素的化合价升高,O元素的化合价降低;③中,Cu2S中Cu元素的化合价降低,S元素的化合价升高;
B.由反应可知,存在6Cu~3Cu2S~6CuFeS2~15O2,以此分析;
C.Cu元素由+1价降低为0,O元素的化合价降低,而S元素的化合价由-2价升高为+4价;
D.反应①中,Cu元素的化合价降低,O元素的化合价降低,S元素的化合价升高.
解答:A.②中S元素的化合价升高,O元素的化合价降低,Cu2S只做还原剂;③中,Cu2S中Cu元素的化合价降低,S元素的化合价升高,Cu2S既是还原剂又是氧化剂,故A错误;
B.由反应可知,存在6Cu~3Cu2S~6CuFeS2~15O2,则1mol CuFeS2生成1molCu,理论上消耗2.5molO2,故B正确;
C.Cu元素由+1价降低为0,O元素的化合价降低,而S元素的化合价由-2价升高为+4价,则转移的电子数为1mol×[4-(-2)]=6mol,故C错误;
D.反应①中,CuFeS2中铜元素的化合价为+2,Cu元素的化合价降低,O元素的化合价降低,S元素的化合价由-2价升高为+4价,2molCuFeS2反应转移电子为24mol,故D错误;
故选B.
点评:本题考查氧化还原反应及计算,明确反应中的元素的化合价变化是解答本题的关键,注意电子守恒、原子守恒的应用,选项D为易错点,题目难度较大.

练习册系列答案
相关题目
火法炼铜可以从黄铜矿(CuFeS2)或辉铜矿(Cu2S)中提取铜,发生如下反应:
①2CuFeS2+4O2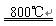
②2Cu2S+3O2 2Cu2O+2SO2
2Cu2O+2SO2
③2Cu2O+Cu2S 6Cu+SO2↑
6Cu+SO2↑
下列说法正确的是 ( )
A.反应② 、③中,Cu2S都只做还原剂 、③中,Cu2S都只做还原剂 |
| B.1molCu2FeS2生成1 mol Cu,理论上消耗2.5 mol O2 |
| C.1molCu2S和O2反应生成2 mol Cu转移的电子数为4 mo1 |
| D.反应①中,共转移的电子数为16mol,CuFeS2中铜元素的化合价为+2 |
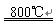 Cu2S+3SO2+2FeO
Cu2S+3SO2+2FeO 2Cu2O+2SO2
2Cu2O+2SO2