题目内容
下列关于电解质溶液的叙述正确的是( )
| A.在0.1 mol·L-1 NaHCO3溶液中:c(OH-)+ c(CO32-)=c(H+)+ c(H2CO3) |
| B.250C时,pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7 |
| C.在纯水中加入少量硫酸或硫酸铵,均可抑制水的电离 |
| D.将氨水和盐酸混合后,所得溶液中可能存在:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
A
解析试题分析:根据质子守恒规律,任何水溶液中水电离得c(OH-)=c(H+), 所以A选项满足质子守恒c(OH-)+ c(CO32-)=c(H+)+ c(H2CO3),即c(OH-)=c(H+)+ c(H2CO3)–c(CO32-),A正确;pH=3的醋酸溶液和pH=11的氢氧化钠溶液c(H+)=c(OH-)=0.001mol/L,但是醋酸是弱酸还有大量未电离,所以二者等体积混合后醋酸过量,溶液呈酸性,B错误;根据H2O≒OH-+H+ 可知,加入酸或碱,c(H+)或c(OH-)增大,会抑制水的电离,硫酸铵是强酸弱碱盐会水解,所以促进水的电离,C错误;根据电荷守恒,混合后的溶液有c(NH4+)+c(H+)=c(Cl-)+c(OH-),所以当c(OH-)>c(H+)时,c(Cl-)<c(NH4+),所以D错误;故选A。
考点:本题考查的是电离平衡、盐类水解、离子浓度大小比较的知识。

含有等物质的量NaOH的溶液分别用pH为2和3的CH3COOH溶液中和,设消耗CH3COOH溶液的体积依次为Va、Vb,则两者的关系正确的是( )
| A.Va>10 Vb | B.Va ="10" Vb |
| C.Vb >10 Va | D.Vb <10 Va |
常温下,用0.10 mol·L-1 KOH溶液滴定10.00 mL 0.10 mol·L-1H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。下列说法正确的是( )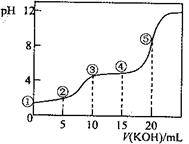
| A.点①所示溶液中: c(H+)/c(OH—)=1012 |
| B.点②所示溶液中:c(K+)+c(H+)=c(HC2O4—)+c(C2O42-)+c(OH—) |
| C.点③所示溶液中:c(K+)>c(HC2O4—)>c(H2C2O4)>c(C2O42-) |
| D.点④所示溶液中:c(K+)+ c(H2C2O4)+ c(HC2O4—) +c(C2O42-)=0.10mol·L-1 |
室温下向10 mL c(H+)=10-3 mol·L-1的醋酸溶液中加水稀释后,下列说法正确的是
| A.溶液中导电粒子的数目减少 |
B.溶液中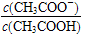 变大 变大 |
| C.醋酸的电离程度增大,c(OH-)亦增大 |
| D.再加入10 mL c(OH-)=10-3 mol·L-1的NaOH溶液,醋酸与NaOH恰好完全反应 |
下列应用与盐类的水解无关的是 ( )
| A.NaCl可用作防腐剂和调味剂 | B.明矾净水 |
| C.泡沫灭火器的灭火原理 | D.FeCl3饱和溶液滴入沸水中制备Fe(OH)3胶体 |
常温下,稀释0.1 mol·L-1Na2CO3溶液,图中的纵坐标可以表示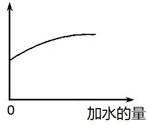
| A.CO32-水解的平衡常数 |
| B.溶液的pH |
| C.溶液中HCO3-的数目 |
| D.溶液中的c(CO32-) |
分别用pH=3和pH=4的醋酸中和等体积等物质的量浓度的NaOH,消耗两种醋酸的体积分别为V1和V2。V1和V2的关系正确的是
| A.V2 =10V1 | B.V1>10 V2 | C.V2<10V1 | D.V2>10V1 |
水的电离过程为H2O H++OH-,在不同温度下离子积为KW(25℃)=1.0×10-14,
H++OH-,在不同温度下离子积为KW(25℃)=1.0×10-14,
KW(35℃)=2.1×10-14。则下列叙述正确的是
| A.c(H+)随温度的升高而降低 | B.35℃时,c(H+)>c(OH-) |
| C.氯化钠溶液中KW (35℃) <KW (25℃) | D.水的电离是吸热的过程 |