题目内容
能正确表示下列反应的离子方程式是
| A.少量的CO2通人氨水中:CO2+NH3·H2O=NH4++HCO3- |
B.Na2O2溶于水中:2Na2O2+2H2O=4Na++4OH-+O2 |
| C.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+ |
D.用惰性电极电解熔融氯化钠:2C1-+2H2O Cl2 Cl2 +H2 +H2 +2OH- +2OH- |
B
解析试题分析:A、少量的CO2通人氨水中,产物应为碳酸铵和水,错误;B、Na2O2溶于水中:2Na2O2+2H2O=4Na++4OH-+O2↑,正确;C、钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-2e-=Fe2+,错误;D、用惰性电极电解熔融氯化钠:2C1-+2Na+ Cl2↑+2Na,错误。
Cl2↑+2Na,错误。
考点:考查离子反应、离子方程式正误判断。

练习册系列答案
相关题目
能在强酸性溶液中大量共存的一组离子是
| A.K+、Cu2+、SO42-、NO3- | B.Na+、Ba2+、Br-、SO42- |
| C.NH4+、Fe3+、Cl-、SCN- | D.K+、Fe2+、Cl-、NO3- |
下列有关电解质溶液说法都正确的是
| A.将10ml0.1mol·L-1Na2CO3溶液逐滴滴加到10ml0.1mol·L-1盐酸中:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-) |
| B.物质的量浓度相等的NaF溶液和CH3COONa溶液相比较,两者离子的总浓度相等 |
| C.向0.1 mol·L-1 FeCl3溶液中滴加少量酸性KMnO4溶液,KMnO4 溶液不褪色,说明FeCl3溶液只有氧化性,无法被氧化剂氧化 |
| D.把AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3的溶液,可观察到大量淡黄色沉淀与少量白色沉淀生成,说明反应后AgCl与AgBr沉淀应都有,但是以AgBr为主,说明Ksp(AgCl)>Ksp(AgBr) |
如图所示装置中,试管内的FeI2溶液中滴有KSCN溶液,实验中控制通入Cl2的速度,试管内先观察到紫色,后观察到红色。下列说法正确的是( )
| A.若Cl2中含较多HCl,实验过程中会产生倒吸现象 |
| B.通入足量Cl2后,振荡试管,下层变紫色,上层变红色 |
| C.该实验可验证氧化性:Cl2>I2>Fe3+ |
| D.试管内反应的离子方程式可表示为Fe2++2I-+Cl2=I2+Fe3++2Cl- |
下列离子方程式书写正确的是( )
| A.在100 mL浓度为1 mol·L-1的 Fe(NO3)3的溶液中通入足量SO22Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
| B.在100 mL浓度为2 mol·L-1的FeI2的溶液中通入标准状况下5.6 L的Cl24Fe2++6I-+5Cl2=4Fe3++3I2+10Cl- |
| C.向NaHCO3溶液中加入过量的澄清石灰水2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32- |
| D.向明矾溶液中加入过量的氢氧化钡溶液Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O |
下列各组离子在指定溶液中一定能大量共存的是( )
| A.能使甲基橙呈红色的溶液:Ba2+、Al3+、NO3—、Cl- |
| B.由水电离出的c(H+)=1×10-11 mol·L-1的溶液:Na+、Mg2+、Cl-、NO3— |
| C.0.2 mol·L-1的NaNO3溶液:H+、Fe2+、SO42—、Cl- |
| D.与Fe反应生成H2的溶液:NH4+、K+、SO42—、CO32— |
水溶液中能大量共存的一组离子是( )
| A.Na+、Al3+、Cl-、CO32— |
| B.H+、Na+、Fe2+、MnO4— |
| C.K+、Ca2+、Cl-、NO3— |
| D.K+、NH4+、OH-、SO42— |
下列表示对应化学反应的离子方程式正确的是( )
| A.用KIO3氧化酸性溶液中的KI:5I-+IO3—+3H2O=3I2+6OH- |
B.向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-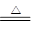 NH3↑+H2O NH3↑+H2O |
| C.将过量SO2通入冷氨水中:SO2+NH3·H2O=HSO3—+NH4+ |
| D.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3—=Ag++NO↑+H2O |
甲、乙两溶液中,分别含有大量的Cu2+、K+、H+、Cl-、CO32—、OH-6种离子中的3种,已知甲溶液呈蓝色,则乙溶液中大量存在的离子是( )
| A.K+、OH-、CO32— | B.Cu2+、H+、Cl- | C.K+、H+、Cl- | D.CO32—、OH-、Cl- |