题目内容
【题目】若NA表示阿伏伽德罗常数的值,则下列说法正确的是
A. 标准状况下,2.24L N2和O2的混合气体中分子数为0.1NA
B. 32g S8(分子结构: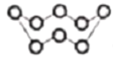 )中的共价键数目为8NA
)中的共价键数目为8NA
C. 3mol SO2和1mol O2于密闭容器中催化反应后分子总数为3NA
D. pH=1的H3BO3溶液中,含有H+的总数为0.3NA
【答案】A
【解析】
A.标准状况下,2.24L N2和O2的混合气体的物质的量是0.1mol,因此其中含有的分子数为0.1NA,A正确;
B.32gS8的的物质的量为n=32g÷256g/mol=0.125mol,S8分子中含有8个S-S键,所以32g S2分子中的共价键数目为0.125mol ×8NA=NA,B错误;
C.SO2与O2反应转化为SO3的反应是可逆反应,反应物不能完全转化为生成物,所以3mol SO2和1mol O2于密闭容器中催化反应后分子总数大于3NA,C错误;
D.缺少溶液的体积,不能计算溶液中含有的氢离子的数目,D错误;
故合理选项是A。

练习册系列答案
相关题目






