题目内容
常温下,下列各溶液中微粒的物质的量浓度关系正确的是( )
分析:A.根据质子守恒判断;
B.二者混合时,混合溶液中溶质为等物质的量浓度的NaCl、NH4Cl、NH3.H2O,一水合氨的电离程度大于铵根离子水解程度而使其溶液呈碱性,再结合电荷守恒分析;
C.相同温度下,不同浓度的醋酸溶液中,醋酸的浓度越大其电离程度越小;
D.相同温度下,酸的电离程度越大,其酸根离子水解程度越小.
B.二者混合时,混合溶液中溶质为等物质的量浓度的NaCl、NH4Cl、NH3.H2O,一水合氨的电离程度大于铵根离子水解程度而使其溶液呈碱性,再结合电荷守恒分析;
C.相同温度下,不同浓度的醋酸溶液中,醋酸的浓度越大其电离程度越小;
D.相同温度下,酸的电离程度越大,其酸根离子水解程度越小.
解答:解:A.根据质子守恒得c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+),故A错误;
B.二者混合时,混合溶液中溶质为等物质的量浓度的NaCl、NH4Cl、NH3.H2O,一水合氨的电离程度大于铵根离子水解程度而使其溶液呈碱性,则c(OH-)>c(H+),氯离子不水解,根据物料守恒知c(Cl-)最大,一水合氨部分电离,则c(NH4+)>c(Na+),故B错误;
C.相同温度下,不同浓度的醋酸溶液中,醋酸的浓度越大其电离程度越小,所以CH3COO-离子浓度前者小于后者的10倍,故C错误;
D.相同温度下,醋酸的酸性大于苯酚,则苯酚钠的水解程度大于醋酸钠,所以浓度均为0.1mol?L-1的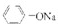 溶液和CH3COONa溶液中:阴离子的总浓度前者小于后者,故D正确;
溶液和CH3COONa溶液中:阴离子的总浓度前者小于后者,故D正确;
故选D.
B.二者混合时,混合溶液中溶质为等物质的量浓度的NaCl、NH4Cl、NH3.H2O,一水合氨的电离程度大于铵根离子水解程度而使其溶液呈碱性,则c(OH-)>c(H+),氯离子不水解,根据物料守恒知c(Cl-)最大,一水合氨部分电离,则c(NH4+)>c(Na+),故B错误;
C.相同温度下,不同浓度的醋酸溶液中,醋酸的浓度越大其电离程度越小,所以CH3COO-离子浓度前者小于后者的10倍,故C错误;
D.相同温度下,醋酸的酸性大于苯酚,则苯酚钠的水解程度大于醋酸钠,所以浓度均为0.1mol?L-1的
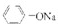 溶液和CH3COONa溶液中:阴离子的总浓度前者小于后者,故D正确;
溶液和CH3COONa溶液中:阴离子的总浓度前者小于后者,故D正确;故选D.
点评:本题考查了离子浓度大小的判断,根据电解质溶液中电荷守恒、物料守恒及质子守恒来分析解答,易错选项是B,明确溶液中的溶质及其性质是解此选项的关键,难度中等.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目