题目内容
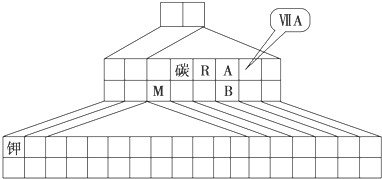
如图是元素周期表的另一种画法--三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置.
回答下列问题:
(1)请在图中将过渡元素所在的位置涂黑.
(2)工业上用于冶炼M的化学方程式为______.
(3)M和R组成化合物MR的超细粉末被广泛应用于大规模集成电路生产等领域.其制取原理是用M的氧化物、R的单质与碳单质在高温下反应,已知反应中三种物质的物质的量之比为1:1:3,该反应的化学方程式为______,反应中______作氧化剂.
(4)图中A、B两元素形成的离子B2A8-2中,B元素呈现最高价,B原子位于由A原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构.该离子可能具有的化学性质是______,依据是______.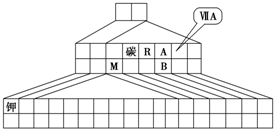
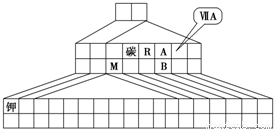
回答下列问题:
(1)请在图中将过渡元素所在的位置涂黑.
(2)工业上用于冶炼M的化学方程式为______.
(3)M和R组成化合物MR的超细粉末被广泛应用于大规模集成电路生产等领域.其制取原理是用M的氧化物、R的单质与碳单质在高温下反应,已知反应中三种物质的物质的量之比为1:1:3,该反应的化学方程式为______,反应中______作氧化剂.
(4)图中A、B两元素形成的离子B2A8-2中,B元素呈现最高价,B原子位于由A原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构.该离子可能具有的化学性质是______,依据是______.

三角形元素周期表的实质是将原周期表的空隙部分进行了删除形成的,与原元素周期表没有本质的区别,所以表中R为氮,A为氧,M为铝,B为硫,在第四周期之后的ⅡA和ⅢA之间为过渡元素,
(1)三角形元素周期表的实质是将原周期表的空隙部分进行了删除形成的,与原元素周期表没有本质的区别,在第四周期之后的ⅡA和ⅢA之间为过渡元素,
故答案为:

(2)M为铝,工业上常用电解Al2O3的方法制备,反应的方程式为2Al2O3
4Al+3O2↑,
故答案为:2Al2O3
4Al+3O2↑;
(3)M的氧化物为Al2O3,R的单质为N2,与碳单质在高温下反应,生成物为AlN,根据三种物质的物质的量之比为1:1:3,结合质量守恒定律可知另一种生成物为CO,则方程式为Al2O3+N2+3C
2AlN+3CO,反应物N2中N元素的化合价降低,则N2为氧化剂,
故答案为:Al2O3+N2+3C
2AlN+3CO;N2;
(4)A、B两元素形成的离子B2A82-中为S2082-,B原子位于由A原子组成的四面体的中心,则离子中含有-O-O-键,即过氧键,应具有氧化性,
故答案为:氧化性;离子结构中存在-O-O-(部分氧元素呈-1价亦可).
(1)三角形元素周期表的实质是将原周期表的空隙部分进行了删除形成的,与原元素周期表没有本质的区别,在第四周期之后的ⅡA和ⅢA之间为过渡元素,
故答案为:

(2)M为铝,工业上常用电解Al2O3的方法制备,反应的方程式为2Al2O3
| ||
故答案为:2Al2O3
| ||
(3)M的氧化物为Al2O3,R的单质为N2,与碳单质在高温下反应,生成物为AlN,根据三种物质的物质的量之比为1:1:3,结合质量守恒定律可知另一种生成物为CO,则方程式为Al2O3+N2+3C
| ||
故答案为:Al2O3+N2+3C
| ||
(4)A、B两元素形成的离子B2A82-中为S2082-,B原子位于由A原子组成的四面体的中心,则离子中含有-O-O-键,即过氧键,应具有氧化性,
故答案为:氧化性;离子结构中存在-O-O-(部分氧元素呈-1价亦可).

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
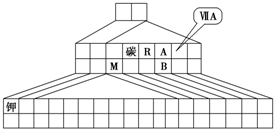 如图是元素周期表的另一种画法--三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置.
如图是元素周期表的另一种画法--三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置.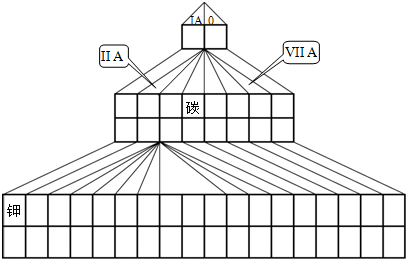
 或
或