题目内容
【题目】用零价铁(Fe)进行水体脱氮、(去除水体中的NO3-),已成为环境修复研究的热点之一。
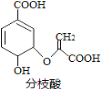
(1)Fe还原水体中NO3-的反应原理如图所示。其中作负极的物质是________,正极的电极反应式是_________。
(2)研究表明,零价铁脱氮后最终会在表面生成不导电的FeO(OH)外皮,从而使得脱氮过程停止。补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;Ⅱ. Fe2+破坏FeO(OH)氧化层。
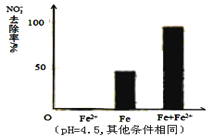
针对假设I:做对比实验,结果如图所示,可得到的结论是_______。
②针对假设II:以同位素示踪法,证实Fe2+能与FeO(OH)反应生成Fe3O4。该反应的离子方程式为_______________,加入Fe2+提高NO3-去除率的原因:____________。
(3)将足量铁粉投入水体中,测定不同初始pH对脱氧的影响见下边左图,初始PH为2.5时氮浓度与pH变化见下边图。结合两图分析,不同初始pH对脱氮产生影响的原因为_________________。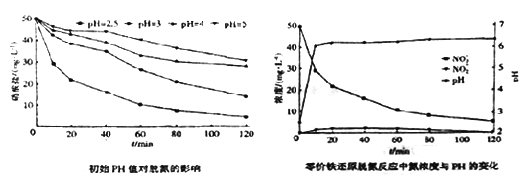
【答案】 铁 NO3-+8e-+l0H+=NH4++3H2O 本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率 Fe2++2FeO(OH)=Fe3O4+2H+ Fe2+将不导电的FeO (OH)转化为可导电的Fe3O4,利于电子的转移 初始pH低时,产生的Fe2+充足;初始pH高时,产生的Fe2+不足
【解析】 (1). ①Fe还原水体中NO3-,则Fe作还原剂,失去电子,作负极;②NO3―在正极得电子,还原成NH4+ ,根据图2信息可知,在酸性环境中,正极的电极反应式是 NO3-+8e-+l0H+=NH4++3H2O ,答案: (1). 铁 (2). NO3-+8e-+l0H+=NH4++3H2O
(2)①从图3的实验结果可以看出,单独加入Fe2+ 时,NO3―的去除率为0,Fe2+ 不能直接还原NO3―,而Fe和Fe2+ 共同加入时NO3―的去除率比单独加Fe时高,因此可得出结论:本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率 答案: (3). 本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率
②证实Fe2+能与FeO(OH)反应生成Fe3O4。该反应的离子方程式为Fe2++2FeO(OH)=Fe3O4+2H+ ,加入Fe2+提高NO3-去除率的原因: Fe2+将不导电的FeO (OH)转化为可导电的Fe3O4,利于电子的转移。答案:(4). Fe2++2FeO(OH)=Fe3O4+2H+ (5). Fe2+将不导电的FeO (OH)转化为可导电的Fe3O4,利于电子的转移
(3)根据实验结果可知Fe2+ 的作用时将不导电的FeOOH转化为可导电的Fe3O4,而NO3―的去除率由铁的最终物质形态确定,因此实验初始pH会影响Fe2+ 的含量,故答案:初始pH低时,产生的Fe2+充足;初始pH高时,产生的Fe2+不足