题目内容
在一定条件下,将1 mol CO和1 mol水蒸气混合后发生如下变化:CO(g)+H2O(g) 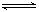 CO2(g)+H2(g)若反应达平衡时测得CO转化率为25%,则平衡混合气体的密度为相同条件下H2密度的
CO2(g)+H2(g)若反应达平衡时测得CO转化率为25%,则平衡混合气体的密度为相同条件下H2密度的
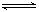 CO2(g)+H2(g)若反应达平衡时测得CO转化率为25%,则平衡混合气体的密度为相同条件下H2密度的
CO2(g)+H2(g)若反应达平衡时测得CO转化率为25%,则平衡混合气体的密度为相同条件下H2密度的| A.5.75倍 | B.11.5倍 | C.30.67倍 | D.46倍 |
B
试题分析:根据反应式CO(g)+H2O(g)
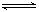 CO2(g)+H2(g)可知,反应前后气体的体积是不变的,则混合物的平均相对分子质量是(28+18)÷2=23。根据阿伏加德罗定律以及推论可知,气体的密度之比是相应的摩尔质量之比,因此混合气的密度是相同条件下氢气密度的23÷2=11.5倍,答案选B。
CO2(g)+H2(g)可知,反应前后气体的体积是不变的,则混合物的平均相对分子质量是(28+18)÷2=23。根据阿伏加德罗定律以及推论可知,气体的密度之比是相应的摩尔质量之比,因此混合气的密度是相同条件下氢气密度的23÷2=11.5倍,答案选B。点评:该题是中等难度的试题,试题基础性强,主要是考查对阿伏加德罗定律以及推论的熟悉掌握程度,以及灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑思维能力。

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目