题目内容
NA表示阿伏加德罗常数的值,下列说法正确的是
- A.常温常压下,22.4L氧气所含的原子数为2NA
- B.18g水所含的电子数为NA
- C.8g He所含的分子数为NA
- D.16g O2与16g O3所含的原子数均是NA
D
分析:A.气体体积与温度和压强有关;
B.根据n= 计算 H2O的物质的量,1个水分子中含有10个电子;
计算 H2O的物质的量,1个水分子中含有10个电子;
C.根据n= 计算 He的物质的量;
计算 He的物质的量;
D.根据n= 计算 16g O2与16g O3的物质的量;
计算 16g O2与16g O3的物质的量;
解答:A.标准状况下,22.4L 氧气的物质的量为1mol,分子数为NA.常温常压下,温度升高,体积膨胀,故22.4L氧气的物质的量小于1mol,气体的分子数小于NA,故A错误;
B.H2O的物质的量为n= =
= =1mol,1个水分子中含有10个电子,1molH2O所含的电子数为10NA,故B错误;
=1mol,1个水分子中含有10个电子,1molH2O所含的电子数为10NA,故B错误;
C.He的物质的量为n= =
=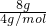 =2mol,所含的分子数为2NA,故C错误;
=2mol,所含的分子数为2NA,故C错误;
D.16g O2的物质的量为n= =
=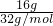 =0.5mol,1个氧气分子中含有2个氧原子,16g O2所含的原子数为0.5mol×2=1mol,16g O3的物质的量为n=
=0.5mol,1个氧气分子中含有2个氧原子,16g O2所含的原子数为0.5mol×2=1mol,16g O3的物质的量为n= =
=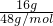 =
=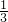 mol,1个臭氧气分子中含有3个氧原子,16g O3的所含的原子数为
mol,1个臭氧气分子中含有3个氧原子,16g O3的所含的原子数为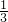 mol×3=1mol,则二者的原子得物质的量相同、原子数相同均是NA,故D正确;
mol×3=1mol,则二者的原子得物质的量相同、原子数相同均是NA,故D正确;
故选D.
点评:本题考查了阿伏伽德罗常数的有关问题,注意物质与微粒的关系,注意单位的运用,题目较简单.
分析:A.气体体积与温度和压强有关;
B.根据n=
 计算 H2O的物质的量,1个水分子中含有10个电子;
计算 H2O的物质的量,1个水分子中含有10个电子;C.根据n=
 计算 He的物质的量;
计算 He的物质的量;D.根据n=
 计算 16g O2与16g O3的物质的量;
计算 16g O2与16g O3的物质的量;解答:A.标准状况下,22.4L 氧气的物质的量为1mol,分子数为NA.常温常压下,温度升高,体积膨胀,故22.4L氧气的物质的量小于1mol,气体的分子数小于NA,故A错误;
B.H2O的物质的量为n=
 =
= =1mol,1个水分子中含有10个电子,1molH2O所含的电子数为10NA,故B错误;
=1mol,1个水分子中含有10个电子,1molH2O所含的电子数为10NA,故B错误;C.He的物质的量为n=
 =
=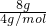 =2mol,所含的分子数为2NA,故C错误;
=2mol,所含的分子数为2NA,故C错误;D.16g O2的物质的量为n=
 =
=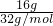 =0.5mol,1个氧气分子中含有2个氧原子,16g O2所含的原子数为0.5mol×2=1mol,16g O3的物质的量为n=
=0.5mol,1个氧气分子中含有2个氧原子,16g O2所含的原子数为0.5mol×2=1mol,16g O3的物质的量为n= =
=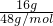 =
=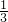 mol,1个臭氧气分子中含有3个氧原子,16g O3的所含的原子数为
mol,1个臭氧气分子中含有3个氧原子,16g O3的所含的原子数为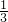 mol×3=1mol,则二者的原子得物质的量相同、原子数相同均是NA,故D正确;
mol×3=1mol,则二者的原子得物质的量相同、原子数相同均是NA,故D正确;故选D.
点评:本题考查了阿伏伽德罗常数的有关问题,注意物质与微粒的关系,注意单位的运用,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目