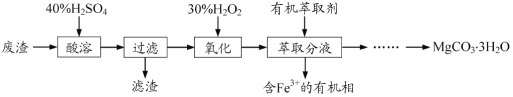
��Ŀ����
����Ŀ����1�������£����ȡ0.1molL-1HA��Һ��0.1molL-1NaOH��Һ�������ϣ���û��Һ��pH=8�����Һ����ˮ�������OH-Ũ����0.1molL-1NaOH��Һ����ˮ�������OH-Ũ��֮��Ϊ__________��
��2����ͬ�¶��£����������ᱵ����ֱ������ͬ�����
��0.1molL-1��������Һ
��0.1molL-1�Ȼ�����Һ
������ˮ
��0.1molL-1������Һ�У�
Ba2+Ũ���ɴ�С��˳���� �����������д��
��3�������£���a molL-1�İ�ˮ��0.1molL-1������������ϣ�����Һ��c��NH4+��=c��Cl-��ʱ���ú�a�Ĵ���ʽ��ʾNH3H2O�ĵ��볣��Kb= ��
���𰸡���1��107��1����2����>��>��>�٣���3��![]()
��������
�����������1��NaAˮ��ʼ��ԣ����Һ����ˮ�������OH��Ũ��������Һ��OHŨ�ȣ�����pH��8�ɵ�c��OH����Kw/c(H+)��10-6molL1��0.1molL��1NaOH��Һ����ˮ�������OH��Ũ��������Һ��H+Ũ�ȣ�ΪKw/c(OH)��10-13molL1���������Һ����ˮ�������OH��Ũ����0.1molL��1NaOH��Һ����ˮ�������OH��Ũ��֮����10-6molL1/10-13molL1��107��1��
��2����ͬ�¶��£���Һ��SO42��Ba2+Ũ��֮��Ϊ����������SO42Ũ��Խ��Ba2+Ũ��ԽС����Ba2+Ũ���ɴ�С��˳�������ڢۢܢ���
��3����a molL��1�İ�ˮ��0.1molL��1������������ϣ���Һ�������Ϊԭ����2������c��NH4+����c��Cl������0.05molL1�����ݵ���غ㣬c��NH4+��+c��H+����c��Cl��+c��OH��������c��H+����c��OH����10-7molL1������ƽ���c��NH3H2O����(a/2��0.05)molL1����NH3H2O�ĵ��볣��Kb��c��NH4+��c��OH��/c(NH3H2O)��0.05��10-7/( a/2��0.05)��![]() ��
��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�