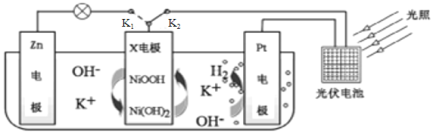
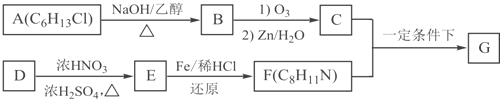
题目内容
【题目】已知:p[![]() ]=-lg[
]=-lg[![]() ]。室温下,向0.10 mol/L HX溶液中滴加0.10 mol/LNaOH溶液,溶液pH随p[
]。室温下,向0.10 mol/L HX溶液中滴加0.10 mol/LNaOH溶液,溶液pH随p[![]() ]变化关系如图所示。下列说法正确的是
]变化关系如图所示。下列说法正确的是
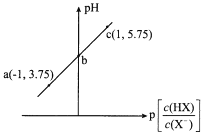
A.溶液中水的电离程度:a>b>c
B.c点溶液中:c(Na+)=10c(HX)
C.室温下NaX的水解平衡常数为10-4.75
D.图中b点坐标为(0,4.75)
【答案】D
【解析】
A. 根据图示可知,a、b、c均为酸性溶液,则溶质为HX和NaX,pH<7的溶液中,HX的电离程度大于X-的水解程度,可只考虑H+对水的电离的抑制,溶液pH越大氢离子浓度越小,水的电离程度越大,则溶液中水的电离程度:a<b<c,A错误;
B. c点溶液中存在电荷守恒:c(H+)+c(Na+)=c(X-)+c(OH-),此时p[ ]=1,则c(X-)=10c(HX),代入电荷守恒可得:c(H+)+c(Na+)=10c(HX)+c(OH-),由于溶液呈酸性,c(H+)> c(OH-),则c(Na+)<10c(HX),B错误;
]=1,则c(X-)=10c(HX),代入电荷守恒可得:c(H+)+c(Na+)=10c(HX)+c(OH-),由于溶液呈酸性,c(H+)> c(OH-),则c(Na+)<10c(HX),B错误;
C. HX在溶液中存在电离平衡:HX![]() H++X-,Ka=
H++X-,Ka=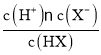 ,则pH=pKa+p[
,则pH=pKa+p[ ],带入c点坐标(1,5.75)可知,pKa=4.75,则Ka=10-4.75,则室温下室温下NaX的水解平衡常数Kh=
],带入c点坐标(1,5.75)可知,pKa=4.75,则Ka=10-4.75,则室温下室温下NaX的水解平衡常数Kh=![]() =10-9.25,C错误;
=10-9.25,C错误;
D. HX在溶液中存在电离平衡:HX![]() H++X-,Ka=
H++X-,Ka=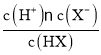 ,则pH=pKa+p[
,则pH=pKa+p[ ],带入c点坐标(1,5.75)可知,pKa=4.75,则b点pH=pKa+p[
],带入c点坐标(1,5.75)可知,pKa=4.75,则b点pH=pKa+p[ ]=0+4.75=4.75,D正确;
]=0+4.75=4.75,D正确;
故合理选项是D。

练习册系列答案
相关题目