题目内容
【题目】SO2和H2S会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题。
(1)用氨水除去SO2:
已知 25℃,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8,NH3·H2O的 Kb=1.8×l0-5。
①试写出H2SO3在水溶液中的电离方程式__________________,从电离平衡的角度解释Ka1、Ka2差别很大的原因_________________。
②若氨水的浓度为0.02 mol·L-1,溶液中的c(OH-)=____________mol·L-1、将SO2通入该氨水中,当溶液中的c(SO32-)/ c(HSO3-)=6.2时,溶液的pH=_____________。
(2)生物脱H2S:
原理为:H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4=2Fe2(SO4)3+2H2O
①硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是_______________ 。
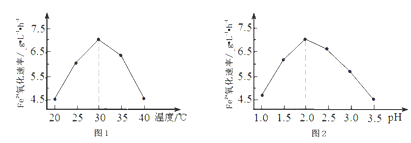
②由图1和图2判断使用硫杆菌的最佳条件为________________ ,若反应温度过高,反应速率下降,其原因是__________________________ 。
【答案】 H2SO3![]() HSO3-+H+ 第一步电离的H+抑制了第二步的电离 6.0×10-4 8.0 降低反应活化能(或作催化剂) 30 °C、pH=2.0 蛋白质变性(或硫杆菌失去活性)
HSO3-+H+ 第一步电离的H+抑制了第二步的电离 6.0×10-4 8.0 降低反应活化能(或作催化剂) 30 °C、pH=2.0 蛋白质变性(或硫杆菌失去活性)
【解析】试题分析:本题考查电离方程式的书写,电离平衡常数的计算,外界条件对化学反应速率的影响,图像的分析。
(1)①H2SO3属于弱酸,在水溶液中的电离方程式为:H2SO3![]() HSO3-+H+、HSO3-
HSO3-+H+、HSO3-![]() H++SO32-。Ka1
H++SO32-。Ka1![]() Ka2的原因是:第一步电离的H+抑制了第二步的电离。
Ka2的原因是:第一步电离的H+抑制了第二步的电离。
②在氨水中存在电离平衡:NH3·H2O![]() NH4++OH-,溶液中c(NH4+)
NH4++OH-,溶液中c(NH4+)![]() c(OH-),c(NH3·H2O)=0.02mol/L-c(NH4+),由于弱碱的电离微弱,则溶液中c(NH3·H2O)
c(OH-),c(NH3·H2O)=0.02mol/L-c(NH4+),由于弱碱的电离微弱,则溶液中c(NH3·H2O)![]() 0.02mol/L,Kb=1.8
0.02mol/L,Kb=1.8![]() 10-5=
10-5= ,c(OH-)=
,c(OH-)=![]() =6
=6![]() 10-4mol/L。H2SO3的Ka2=[c(H+)·c(SO32-)]/c(HSO3-)=6.2
10-4mol/L。H2SO3的Ka2=[c(H+)·c(SO32-)]/c(HSO3-)=6.2![]() 10-8,当溶液中的c(SO32-)/ c(HSO3-)=6.2时,c(H+)=10-8mol/L,溶液的pH=-lg c(H+)=8。
10-8,当溶液中的c(SO32-)/ c(HSO3-)=6.2时,c(H+)=10-8mol/L,溶液的pH=-lg c(H+)=8。
(2)①硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用作催化剂,降低反应的活化能,加快反应速率。
②由图①判断最佳温度为30℃,由图②判断最佳pH为2.0,最佳条件为30℃、pH=2.0。若反应温度过高,反应速率下降的原因是:温度过高,蛋白质(或硫杆菌)发生变性,失去活性。

【题目】KCl与KNO3在不同温度的溶解度数据如下表.则下列说法正确的是( )
温度/℃ | 10 | 20 | 30 | 40 | 50 |
KCl | 30g | 33g | 35g | 38g | 41g |
KNO3 | 21g | 31g | 45g | 65g | 88g |
A.KNO3比KCl的溶解度大
B.两种物质的溶解度相等的温度在20~30℃间
C.在20℃时,10g水中加入5gKCl可得到33.3% 的KCl溶液
D.在50℃时,两物质各5g分别加入l0g水中,充分溶解,均有固体剩余
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
A | B | C | D | |
实验 | 用CCl4提取 溴水中的Br2 | 除去氢氧化铁 胶体中的氯化钠 | 从KI和I2的固体混合物中回收I2 | 配制100 mL0.1 mol·L-1 NaCl溶液 |
装置或 仪器 |
|
|
|
|
A. A B. B C. C D. D