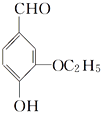
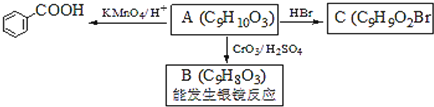
题目内容
【题目】可逆反应:2NO2(g)![]() 2NO(g)+O2(g)在体积固定的密闭容器中进行,不能判断该反应达到平衡状态的标志是( )
2NO(g)+O2(g)在体积固定的密闭容器中进行,不能判断该反应达到平衡状态的标志是( )
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时生成2nmolNO
③用NO2、NO、O2表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态.
A. ①④⑥B. ②③⑤C. ①③④⑤D. 全部
【答案】B
【解析】
在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。据此判断。
①单位时间内生成nmolO2的同时生成2nmolNO2,正逆反应速率相等,反应达到平衡状态,故正确;
②无论该反应是否达到平衡状态,单位时间内生成nmolO2的同时生成2nmolNO,不能据此判断平衡状态,故错误;
③无论该反应是否达到平衡状态,用NO2、NO、O2表示的反应速率的比为2:2:1,不能据此判断平衡状态,故错误;
④混合气体的颜色不再改变时,各物质的浓度不变,该反应达到平衡状态,故正确;
⑤反应前后气体的质量不变、容器的体积不变,所以密度始终不变,所以不能据此判断平衡状态,故错误;
⑥该反应的反应前后气体的物质的量改变,混合气体的平均相对分子质量不再改变时该反应达到平衡状态,故正确。
答案选B。

 名校通行证有效作业系列答案
名校通行证有效作业系列答案【题目】下表实验、现象和结论均正确的是
选项 | 实验 | 现象 | 结论 |
A | 向浓度均为0.lmol·L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
B | 向某溶液中滴加足量稀硫酸 | 溶液中出现了气泡和淡黄色浑浊 | 溶液中可能含有S2O32- |
C | 常温下,用pH试纸测定等物质的量浓度的NaCN和NaClO溶液pH | 前者的 pH比后者的大 | 水解程度:CN-<ClO- |
D | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体(已知FeCl3 +KSCN | 溶液颜色变浅 | 平衡向逆反应方向移动 |
A. A B. B C. C D. D
【题目】某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得0.1mol/L的Na2SO3溶液pH=11,其原因是___________(用离子方程式解释)
(2)调节pH,对两者的反应进行了如下实验并记录了实验现象(实验都在锥形瓶中完成,且所用锥形瓶均进行振荡)
实验 | pH | 实验现象 |
1 | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
2 | 6 | 产生白色沉淀,放置长时间后无变化 |
3 | 2 | 产生白色沉淀,一段时间后,变为棕黑色海绵状沉淀X |
已知:
A.Ag2SO3:白色不溶于水,能溶于过量Na2SO3溶液
B.Ag2SO4:白色微溶于水,只能溶于浓硝酸
C.Ag2O:棕黑色,能与酸反应
①根据以上信息,解释实验1中白色沉淀溶解可能的原因___________
②甲同学对于实验2中的白色沉淀的成分,提出如下猜想
猜想1:白色沉淀为Ag2SO3
猜想2:白色沉淀为Ag2SO4
猜想3:白色沉淀中既有Ag2SO3也有Ag2SO4
为了证明其猜想,甲同学过滤实验2中的白色沉淀,加入_________溶液,发现白色沉淀部分溶解;再将剩余固体过滤出来,加入_________溶液,沉淀完全溶解,由此证明猜想3成立。
(3)乙同学为了确定实验3中棕黑色沉淀X的成分,做了如下实验
①向X中加入稀盐酸,无明显变化
②向X中加入过量浓硝酸,有红棕色气体生成
③分别用Ba(NO3)2溶液和BaCl2溶液检验实验②反应后的溶液,发现前者无变化,后者产生白色沉淀,其中,实验①的目的为___________,由上述实验现象可确定沉淀X的成分为___________(填化学式),实验②的化学方程式为___________。