题目内容
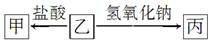
有A、B、C、D、E和F六瓶无色溶液,它们都是中学化学中常用的无机试剂。E的溶质是一种无色油状液体;B、C、D和F是盐溶液,且它们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;②将A分别加入其他五种溶液中,只有D、F中有沉淀产生,继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。根据上述实验信息,下列说法错误的是( )
A.B可能是NaHCO3溶液
B.F为AgNO3溶液
C.D不可能是镁或铝的盐酸盐
D.A为氨水,E为硫酸
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;②将A分别加入其他五种溶液中,只有D、F中有沉淀产生,继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。根据上述实验信息,下列说法错误的是( )
A.B可能是NaHCO3溶液
B.F为AgNO3溶液
C.D不可能是镁或铝的盐酸盐
D.A为氨水,E为硫酸
A
由题干表述可知A和E不是盐,又由E为无色油状液体,推知E为浓硫酸(③步操作进一步确定);由题干和①步操作可知A为氨水;再由②步操作可知F中阳离子为Ag+,发生的反应为Ag++NH3·H2O=AgOH↓+NH4+,AgOH+2NH3·H2O=[Ag(NH3)2]+OH-+2H2O,而常见的银盐中只有AgNO3可溶于水,故F为AgNO3;由③步操作可知盐B与E(H2SO4)放出的无色无味的气体只能是CO2,所以B中阴离子应为CO32-或HCO3-,C、D、F生成沉淀说明应该是CO32-,而阳离子可以是常见的K+、Na+、NH4+等待定;同样由②步操作知,能与氨水生成沉淀的无色溶液中常见的阳离子为Mg2+或Al3+,由于题中只说B(含CO32-)与D生成沉淀,并没指出有无气体,所以D可能含Mg2+,也可能含Al3+,D的阴离子在此处不能确定;由④步知C与D、E(H2SO4)、F(AgNO3)生成不溶于HNO3的沉淀,所以C必为BaCl2;进而推出D中阴离子应该为SO42-,故D为Al2(SO4)3或MgSO4。
点拨:本题考查物质的推断,考查考生对元素化合物知识的理解能力。难度较大。
点拨:本题考查物质的推断,考查考生对元素化合物知识的理解能力。难度较大。

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
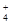 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)