题目内容
设水的电离平衡线如图所示:(1)若以A点表示20 ℃时水在电离平衡时的离子浓度,当温度上升到100 ℃时,水的电离平衡状态到B点。则此时水的离子积从_________增大到_________。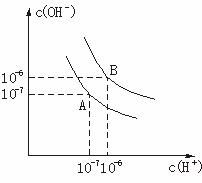
(2)将100 ℃时pH=8的Ba(OH)2溶液与pH=5的稀H2SO4混合,并保持100 ℃的恒温。欲使混合液的pH=7,则Ba(OH)2与稀H2SO4的体积比为_________(二者混合后体积假设为二者体积之和)。
解析:(1)20 ℃时c(H+)=10-7 mol·L-1,
c(OH-)=10-7 mol·L-1,
KW=c(H+)·c(OH-)=10-14,
100 ℃时,c(H+)=10-6 mol·L-1,
c(OH-)=10-6 mol·L-1,
KW=c(H+)·c(OH-)=10-12。
(2)设Ba(OH)2的体积为Vb、稀H2SO4的体积为Va,则二者混合后体积为Va+Vb,100 ℃时,pH=7,c(OH-)>c(H+)。
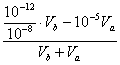 =
=![]() ,
,
所以![]() =
=![]() 。
。
答案:(1)10-14 10-12 (2)2∶9

练习册系列答案
相关题目
 比为_________。
比为_________。 D2O)的离子积常数为1×10-12。若用pH一样的定义来规定pD值,则pD=-lg{ c(D+)}。该温度下:纯重水的pD=_____,1L溶有0.01molNaOD的D2O溶液,其pD="___" ,1 00mL0.1mol/L的D2SO4溶液与100mL0.4mol/L的KOD的D2O溶液混合,pD=______。
D2O)的离子积常数为1×10-12。若用pH一样的定义来规定pD值,则pD=-lg{ c(D+)}。该温度下:纯重水的pD=_____,1L溶有0.01molNaOD的D2O溶液,其pD="___" ,1 00mL0.1mol/L的D2SO4溶液与100mL0.4mol/L的KOD的D2O溶液混合,pD=______。
