题目内容
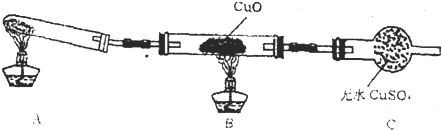
某同学设计如图装置,研究非金属元素性质变化规律。
(1)已知硅酸(H2SiO3)是一种难溶于水的弱酸,呈白色。在化学反应中,一般地,强酸能制弱酸,如NaHCO3+HCl===NaCl+CO2↑+H2O,得出:HCl酸性强于H2CO3的酸性。现有硝酸溶液、碳酸钙、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:酸性:HNO3>H2CO3>H2SiO3。
A中装试剂________,B中装试剂____________,C中装试剂____________。C中实验现象为____________;写出C中发生反应的离子方程式_________________________________________。
(2)已知高锰酸钾在常温下与浓盐酸反应产生氯气,利用如图装置证明氯气氧化性强于碘单质的氧化性。则A中装浓盐酸,B中装入高锰酸钾粉末,C中装试剂________,C中现象________,写出离子方程式__________________。该实验装置有明显不足,请指出改进方法:_______________________________________。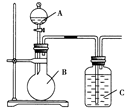
(3)如果C中装饱和的氢硫酸溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察到现象是C中产生淡黄色沉淀,写出化学方程式______________________________;
证明氯的非金属性比硫的非金属性________(填“强”或“弱”或“无法判断”)。
(1)硝酸溶液 碳酸钙 硅酸钠溶液 产生白色沉淀
CO2+SiO32-+H2O===H2SiO3↓+CO32-
(2)淀粉-KI溶液 溶液变蓝色 2I-+Cl2===I2+2Cl-
增加装有氢氧化钠溶液的尾气吸收装置
(3)Cl2+H2S=== S↓+2HCl 强
解析

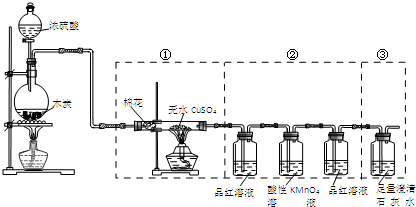
| A、实验时可观察到装置①中白色硫酸铜粉末变蓝色 | B、装置②中两次用到品红溶液的作用相同 | C、装置③用于检验产物中二氧化碳气体的生成 | D、如果将仪器的连接顺序变为②③①,同样可以检出所有气体产物 |
 某同学设计如图装置,研究非金属元素性质变化规律.
某同学设计如图装置,研究非金属元素性质变化规律. 某同学设计如图装置制取少量溴苯,请回答下列问题:
某同学设计如图装置制取少量溴苯,请回答下列问题: