��Ŀ����
����Ŀ��ij��ѧʵ��С��ѡ��ͼ��ʾװ�ú����������Լ���֤���ǽ����ԣ�Cl��I�� 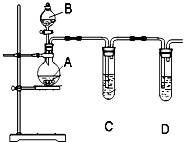
���㰴�����ǵ����˼·��ɸ�ʵ�飮
���ɹ�ѡ����Լ��С�
��ϡ���ᣬ��Ũ���ᣬ��MnO2 �� ��Ũ���ᣬ�ݵ��۵⻯����Һ����KMnO4 �� ��NaOH��Һ������������Һ��
��ƿA��Ӧʢ�ŵ�ҩƷ��������ţ����Թ�C��Ӧʢ�ŵ�ҩƷ��������ţ�����װ��D�������� �� ���۲쵽���� �� ����֤���ǽ�����Cl��I��
���𰸡��ޣ��ݣ�����δ��Ӧ�����������ֹ��Ⱦ������C����Һ����
���������⣺KMnO4��Ũ���ᷴӦ������������������۵⻯�ػ����Һ��Ӧ���ɵⵥ�ʣ�����������Һ����ɫ����C����Һ��Ϊ��ɫ��
��������۵⻯�ػ����Һ��Ӧ���ӷ���ʽΪ��Cl2+2I���T2Cl��+I2 �� ��֤���˷ǽ����ԣ�Cl��I��������ƿA��Ӧʢ�ŵ�ҩƷ��
KMnO4 �� ��C��Ӧʢ�ŵ�ҩƷ�Ƿ۵⻯����Һ����װ��D���������������������ն�������������۲쵽������Һ��Ϊ��ɫ��֤���ǽ�����Cl��I��
���Դ��ǣ��ޣ��ݣ�����δ��Ӧ�����������ֹ��Ⱦ������C����Һ������
�����㾫�����������⣬������Ҫ�˽�ǽ�����Ԫ�����ڱ��е�λ�ü������ʵݱ�Ĺ���(��Ŀǰ��֪��112��Ԫ���У��ǽ���Ԫ����22�֣���H��ǽ���Ԫ�ض�λ�����ڱ������Ϸ���H�����Ϸ�����F�Ƿǽ�������ǿ��Ԫ��)��