题目内容
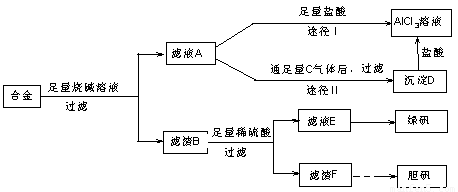
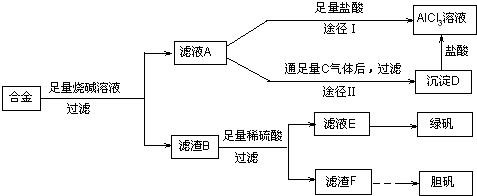
某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如图:
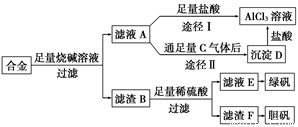
试完成下列各题:
(1)过滤用的器材已有滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是________________________________________________________________________。
(2)由滤液A制得AlCl3溶液有途径Ⅰ和Ⅱ两条,你认为合理的是________,理由是________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(3)写出合金与烧碱溶液反应的离子方程式
________________________________________________________________________
________________________________________________________________________。
(4)写出用滤渣F制备胆矾晶体的化学方程式
________________________________________________________________________
________________________________________________________________________。
(5)有同学提出可将方案中最初溶解合金的烧碱溶液改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理?________,理由是
________________________________________________________________________
________________________________________________________________________。
(1)漏斗、玻璃棒
(2)途径Ⅱ 因为滤液A是NaAlO2溶液,按途径Ⅰ直接向A加入盐酸得到的AlCl3溶液中含有大量的NaCl杂质;按途径Ⅱ,通入C(CO2)气体,得D[Al(OH)3]沉淀,将Al(OH)3溶解于盐酸中得到的是纯净的AlCl3溶液。所以途径Ⅱ更合理
(3)2Al+2OH-+2H2O===2AlO2-+3H2↑
(4)2Cu+O2 2CuO,
2CuO,
CuO+H2SO4===CuSO4+H2O,
CuSO4+5H2O===CuSO4·5H2O(合并后面两个化学方程式,也可)
(5)不合理 该方案不符合实验方案设计的简约性原则,即操作步骤多、消耗试剂量更大、时间过长
【解析】
试题分析:(1)联想过滤装置,可知需补充的玻璃仪器有漏斗和玻璃棒。
(2)由题意知滤液A为NaAlO2溶液,若按途径Ⅰ,则发生反应NaAlO2+4HCl===NaCl+AlCl3+2H2O,所得AlCl3溶液中会含有大量NaCl杂质,而按途径Ⅱ时,NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3,过滤得纯净Al(OH)3,Al(OH)3+3HCl===AlCl3+3H2O,所得AlCl3不含杂质,故合理的为途径Ⅱ。
(3)NaOH只与合金中的Al反应,生成NaAlO2和H2。
(4)滤渣F为Cu,由Cu制备胆矾一般经过以下几个反应:
2Cu+O2 2CuO,CuO+H2SO4===CuSO4+H2O,CuSO4+5H2O===CuSO4·5H2O。
2CuO,CuO+H2SO4===CuSO4+H2O,CuSO4+5H2O===CuSO4·5H2O。
(5)若按该同学的方案需经如下的转化:
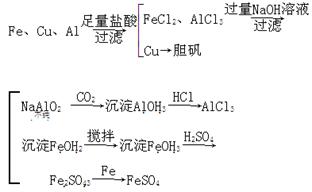
显然操作步骤多,消耗试剂量更大,所需时间过长。
考点:考查仪器的选择、物质的制备、基本操作以及实验设计和评价的有关判断
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,难易适中,侧重对学生基础知识的巩固与训练,同时也注重对学生答题能力的培养和方法指导,有利于培养学生的逻辑思维能力和发散思维能力。该类试题是一类综合性较强的试题,它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。

 步步高达标卷系列答案
步步高达标卷系列答案

 。
。