题目内容
双氧水(H2O2)是一种极弱电解质,也是一种“绿色氧化剂”,为了贮存、运输的方便,工业上将其转化为固态过碳酸钠晶体(化学式为2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O2的双重性质。(1)若把H2O2看成是二元弱酸,请写出它在水中的电离方程式________________________。
(2)水电离生成H3O+和OH-叫做水的自偶电离。同水一样,H2O2也有极微弱的自偶电离,其自偶电离的方程式为________________________________________。
(3)下列物质不会使过碳酸钠失效的是( )
A.MnO2 B.NaHCO
(4)稀硫酸不与铜反应,但在稀硫酸中加入H2O2后,则可使铜顺利溶解,写出该反应的化学方程式,标明电子转移的方向和数目。
解析:解答此题要注意提取题中信息,并找好类比对象,如(1)可与H2CO3类比。(2)与水类似。(3)注意“具有Na2CO3和H2O2的双重性质”即与Na2CO3、H2O2反应立即失效。

(3)B
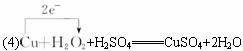

双氧水(H2O2)是一种极弱电解质,也是一种“绿色氧化剂”。为了贮存、运输的方便,工业上将其转化为固态过碳酸钠(2Na2CO4·3H2O),该物质具有Na2CO3与H2O2的双重性质。请回答下列问题:
(1)写出H2O2的电子式: ,并写出它与SO2反应的化学方程式 。
(2)若把H2O2看成二元弱酸,写出它在水中第一步电离的方程式 。
(3)下列物质不会使过碳酸钠失效的是
| A.MnO2 | B.NaHCO3 | C.H2S | D.CH3COOH |
(5)H2O2成为“绿色氧化剂”的理由是 。
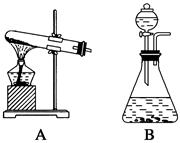
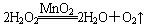 。反应中MnO2的作用是________。在实验室利用此反应制取氧气时,应选用的气体发生装置是________,简述检查本装置气密性的方法:______________________________________________。
。反应中MnO2的作用是________。在实验室利用此反应制取氧气时,应选用的气体发生装置是________,简述检查本装置气密性的方法:______________________________________________。
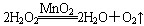 。反应中MnO2的作用是________。在实验室利用此反应制取氧气时,应选用的气体发生装置是________,简述检查本装置气密性的方法:______________________________________________。
。反应中MnO2的作用是________。在实验室利用此反应制取氧气时,应选用的气体发生装置是________,简述检查本装置气密性的方法:______________________________________________。