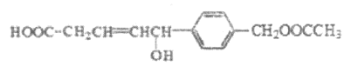
题目内容
【题目】有四种原子:①11H ②3517Cl ③3717Cl ④2311Na。
(1)上述原子中互为同位素的是___________(填序号)。
(2)①和②形成的化学键是___________(填“极性键”或“非极性键”)。
(3)由上述元素形成的物质中,任写一种含离子键的物质的电子式___________。
【答案】②③ 极性键 ![]()
【解析】
(1)同位素是质子数相同中子数不同的原子的互称,是同种元素的不同核素;
(2)由不同种非金属元素形成的共价键为极性键,由同种元素形成的共价键为非极性键;
(3)活泼金属元素和活泼非金属元素之间形成的化学键为离子键。
(1)3517Cl和3717Cl的质子数都为17,中子数分别为18和20,两者互为同位素,故答案为:②③;
(2)①和②形成的化合物为11H3517Cl,11H3517Cl属于共价化合物,含有极性键,故答案为:极性键;
(3)钠元素与氯元素形成的化合物为氯化钠,氯化钠为离子化合物,含有离子键,电子式为![]() ,故答案为:
,故答案为:![]() 。
。

练习册系列答案
相关题目
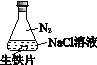
【题目】研究生铁的锈蚀,下列分析不正确的是
序号 | ① | ② | ③ |
实验 |
|
|
|
现象 | 8小时未观察 到明显锈蚀 | 8小时未观察 到明显锈蚀 | 1小时观察 到明显锈蚀 |
A. ①中,NaCl溶液中溶解的O2不足以使生铁片明显锈蚀
B. ②中,生铁片未明显锈蚀的原因之一是缺少H2O
C. ③中正极反应:O2+4e+ 2H2O ==4OH
D. 对比①②③,说明苯能隔绝O2