题目内容
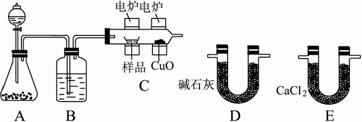
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度(通过CO2与样品反应后生成O2的量测定Na2O2的含量)。
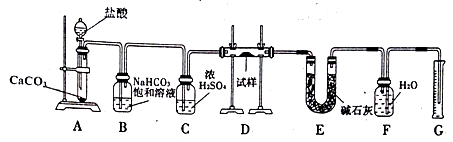
回答下列问题:
(1)装置B的作用是_____________;装置C的作用是____________;装置E中碱石灰的作用是_______。
(2)装置D中发生反应的化学方程式是:_________________。
(3)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则Na2O2试样的纯度为_______________。
【答案】(1)除去气体中的HCl;干燥气体;吸收装置D中反应剩余的二氧化碳;
(2)2Na2O2+2CO2=2Na2CO3+O2,Na2O+CO2=Na2CO3;
(3)78%。
【解析】
试题分析:(1)碳酸钙和盐酸反应生成的二氧化碳气体中含有氯化氢气体,可以用饱和碳酸氢钠来除去,浓硫酸具有吸水性,可以将二氧化碳干燥,装置E中碱石灰的作用是吸收二氧化碳,防止对氧气的体积测量造成干扰,故答案为:除去气体中的HCl;干燥气体;吸收装置D中反应剩余的二氧化碳;
(2)氧化钠和过氧化钠和二氧化碳反应的原理方程式分别为:2Na2O2+2CO2=2Na2CO3+O2,Na2O+CO2=Na2CO3,故答案为:2Na2O2+2CO2=2Na2CO3+O2,Na2O+CO2=Na2CO3;
(3)根据反应2Na2O2+2CO2=2Na2CO3+O2,反应结束后测得气体体积为224mL(标准状况),即生成的氧气的量0.01mol,过氧化钠的物质的量为0.02mol,过氧化钠的纯度=![]() ×100%=78%,故答案为:78%。
×100%=78%,故答案为:78%。

 阅读快车系列答案
阅读快车系列答案【题目】下表是元素周期表的一部分,针对表中①~⑩种元素,填写下列空白:
主族 | ⅠA | ⅡA | Ⅲ A | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ |
(1)被选作相对原子质量标准的核素是 (填核素符号)。
(2)在最高价氧化物的水化物中,酸性强的化合物的化学式是 ,碱性最强的化合物的化学式是 。
(3)最高价氧化物是两性氧化物的元素其单质与氢氧化钠溶液反应的离子方程式为 。
(4)从⑤到⑧的元素中, 离子半径最小(填离子符号)。
(5)元素③与⑤形成的具有强氧化性的化合物的电子式 。
(6)若要比较⑤比⑥的金属性强弱,下列实验方法可行的是 。
A.将单质⑤置于⑥的盐溶液中,如果⑤不能置换出单质⑥,说明⑤的金属性弱
B.比较⑤和⑥的最高价氧化物对应水化物的水溶性,前者比后者溶解度大,故前者金属性强
C.将⑤、⑥的单质分别投入到水中,观察到⑤与水反应更剧烈,说明⑤的金属性强
D.将⑤、⑥的单质分别在O2中燃烧,前者得到氧化物的颜色比后者得到氧化物的颜色深,则前者金属性强