题目内容
关于铜锌原电池和电解CuCl2溶液的装置(如图),下列说法正确的是( )
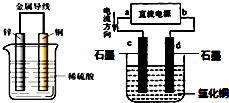
| A.锌是负极,铜片上有气泡产生,电流从锌片经导线流向铜片 |
| B.铜片质量逐渐减少,氢离子在铜片表面被还原 |
| C.d为阳极,电极反应为:2Cl--2e-=Cl2↑ |
| D.电解过程中,d电极质量增加 |

A、锌、铜和稀硫酸组成的原电池中,锌作负极,铜作正极,正极上氢离子得电子生成氢气,电流从正极铜沿导线流向负极锌,故A错误;
B、原电池中,Cu作正极,铜片不反应,所以铜片质量不变,故B错误;
C、电解池中d是阴极,阴极上得电子发生还原反应,溶液中铜离子得电子生成铜,所以电极反应式为Cu2++2e-=Cu,故C错误;
D、d是阴极,阴极上得电子发生还原反应,溶液中铜离子得电子生成铜附着在d极上,所以d电极质量增加,故D正确;
故选D.
B、原电池中,Cu作正极,铜片不反应,所以铜片质量不变,故B错误;
C、电解池中d是阴极,阴极上得电子发生还原反应,溶液中铜离子得电子生成铜,所以电极反应式为Cu2++2e-=Cu,故C错误;
D、d是阴极,阴极上得电子发生还原反应,溶液中铜离子得电子生成铜附着在d极上,所以d电极质量增加,故D正确;
故选D.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目
 关于铜锌原电池和电解CuCl2溶液的装置(如图),下列说法正确的是( )
关于铜锌原电池和电解CuCl2溶液的装置(如图),下列说法正确的是( )

