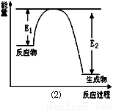
��Ŀ����
�Ȼ�����Ʒ�к�������̼��ء�����غͲ�����ˮ�����ʣ�Ϊ���ᴿ�Ȼ��أ��Ƚ���Ʒ��������ˮ�У���ֽ������ˣ��ڽ���Һ��ͼ��ʾ������в�����
�ش��������⣺
��1����ʼ��Һ��pH�� ��7������ڡ�����С�ڡ����ڡ�������ԭ������ ����
��2���Լ�I�Ļ�ѧʽΪ�� �������з�����Ӧ�����ӷ���ʽΪ�� ����
��3���Լ����Ļ�ѧʽΪ�� �������м����Լ�����Ŀ������ ����
��4���Լ������������� �������з�����Ӧ�����ӷ���ʽΪ�� ����
��5��ijͬѧ��ȡ�ᴿ�IJ�Ʒ0.7759g���ܽ������100mL����ƿ�У�ÿ��ȡ25.00mL��Һ����0.1000mol?L��1������������Һ�ζ������εζ����ı���Һ��ƽ�����Ϊ25.62mL���ò�Ʒ�Ĵ���Ϊ�� ��������ʽ����������
��1�����ڣ�K2CO3ˮ�⣨2���Ȼ�����SO42��+Ba2+=BaSO4����CO32��+Ba2+=BaCO3������3��K2CO3��������BaCl2����4�����CO32��+2H+=CO2��+H2O����5��98.4%��
����������1��ǿ��������ˮ�����Һ������������Ũ�ȴ���������Ũ�ȣ���ˮ��Һ�ʼ��ԣ�
��2�����Ȼ�����Һ����ͬʱ��ȥ��������Ӻ�̼������ӣ��������ӷ���ʽ����д������д��
��3��Ϊ��ȥ�����ı�����ѡ��K2CO3���Լ��������ܳ�ȥ������ͬʱ�������Ȼ��أ�
��4������������ȥ������̼������ӣ��������ӷ���ʽ����д������д��ע��������ʺ�����д��ѧʽ��
��5���ȸ��������������ʵ�������25mL�Ȼ�����Һ�к��е��Ȼ��ص����ʵ������ټ���100mL�Ȼ�����Һ�к��е��Ȼ��ص����ʵ������Ӷ����������������������������ʽ�����������������ɣ�
��������
��1��̼�����ǿ����������ˮ�����Һ������������Ũ�ȴ���������Ũ�ȣ�������Һ�ʼ��ԣ�PH��7��
�ʴ�Ϊ�����ڣ�K2CO3ˮ�⣮
��2��Ҫ�������������������̼�����Ӧ����������Ȼ�����Һ��̼�������������ɲ�����ˮ�ı��Σ�ͬʱ�����Ȼ��أ����ӷ���ʽΪ��SO42��+Ba2+=BaSO4����CO32��+Ba2+=BaCO3����
�ʴ�Ϊ���Ȼ�����SO42��+Ba2+=BaSO4����CO32��+Ba2+=BaCO3����
��3��Ҫ��������ı����ӣ�Ҫ����̼��أ�̼��غ��Ȼ�����Ӧ����̼�ᱵ����ͬʱ�����Ȼ��أ����ӷ���ʽΪCO32��+Ba2+=BaCO3����
�ʴ�Ϊ��K2CO3��������BaCl2��
��4��Ҫ���������̼�����Ҫ�μ����������ᣬ̼������Ӻ����ᷴӦ���ɶ�����̼��ˮ�����ӷ���ʽΪCO32��+2H+=CO2��+H2O��
�ʴ�Ϊ�����CO32��+2H+=CO2��+H2O��
��5����25mL�Ȼ�����Һ���Ȼ��ص����ʵ���Ϊnmol��
KCl+AgNO3=AgCl+KNO 31mol 1mol
nmol 0.1000mol?L��1 ��0.02562L
n=0.002562mol
100mL��Һ�к����Ȼ��ص����ʵ���=0.002562mol��4=0.010248mol
100mL��Һ�к����Ȼ��ص�����=0.010248mol��74.5g/mol=0.764376g
��������=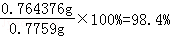 ��
��
�ʴ�Ϊ��98.4%��