题目内容
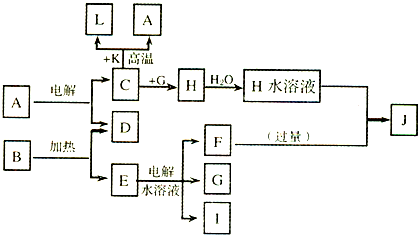
已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态;形成D的元素的原子最外层电子数是次外层的3倍;B在焰色反应中呈紫色(透过蓝色钴玻璃).
请回答:
(1)已知K为红棕色粉末,写出C与K反应的化学方程式
(2)写出C与F反应的离子方程式
(3)若在上述转化关系中每一步反应均为恰好反应,且不考虑C+K→A+L的变化时,为了最终得到J,则A、B的物质的量之比为
B含有钾元素且分解时能生成氧气,根据中学知识知,B是KClO3,E为KCl,电解氯化钾溶液生成氯气、氢气和氢氧化钾,G和I是气体,则F为KOH,氧气和G能反应,则G是Cl2,I为H2,H是AlCl3,氯化铝和氢氧化钾溶液反应生成偏铝酸钾溶液,则J是KAlO2.
B含有钾元素且分解时能生成氧气,根据中学知识知,B是KClO3,E为KCl,电解氯化钾溶液生成氯气、氢气和氢氧化钾,G和I是气体,则F为KOH,氧气和G能反应,则G是Cl2,I为H2,H是AlCl3,氯化铝和氢氧化钾溶液反应生成偏铝酸钾溶液,则J是KAlO2,
(1)已知K为红棕色粉末,则K是Fe2O3,该铝热反应方程式为Fe2O3+2Al
| ||
故答案为:Fe2O3+2Al
| ||
(2)C是铝,F是氢氧化钾,铝和氢氧化钾溶液反应生成偏铝酸钾和氢气,离子反应方程式为:
2Al+2H2O+2OH-═2AlO2-+3H2↑,故答案为:2Al+2H2O+2OH-═2AlO2-+3H2↑;
(3)若在上述转化关系中每一步反应均为恰好反应,且不考虑C+K→A+L的变化时,为了最终得到J,发生的反应为:Al2O3~2Al~2Al3+,KClO3~KCl~KOH,若铝离子和过量氢氧化钾反应生成J为KAlO2,则Al3++4OH-=AlO2-,依据反应可知,需要Al2O3和KClO3物质的量为1:8反应生成KAlO2,故答案为:1:8.

 同步轻松练习系列答案
同步轻松练习系列答案A~J分别代表中学化学中常见的一种单质或化合物,其转化关系如图。
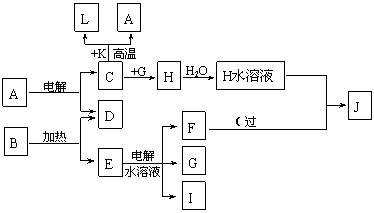 |
已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态;形成D的元素的原子最外层电子数是次外层的3倍;B在焰色反应中呈紫色(透过蓝色钴玻璃)。
请回答:
(1)I在G中燃烧时的现象为________________________________。
(2)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,写出电解E水溶液的化学方程式_____________________________________。
(3)已知K为红棕色粉末,写出C与K反应的化学方程式______________________,引发该反应的操作为______________________________________________。
(4)J与H反应的离子方程式为_________________________________。若在上述转化关系中每一步反应均为恰好反应,且不考虑C+K→A+L的变化时,为了最终得到J,则A、B的物质的量之比为_____________。
(08福建政和一中模拟)A~J分别代表中学化学中常见的一种单质或化合物,其转化关系如图
|
已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态;形成D的元素的原子最外层电子数是次外层的3倍;B在焰色反应中呈紫色(透过蓝色钴玻璃)。
请回答:
(1)I在G中燃烧时的现象为 。
(2)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,写出电解E水溶液的化学方程式 。
(3)已知K为红棕色粉末,写出C与K反应的化学方程式 ,
引发该反应的操作为 。
(4)J与H反应的离子方程式为 。若在上述转化关系中每一步反应均为恰好反应,且不考虑C+K→A+L的变化时,为了最终得到J,则A、B的物质的量之比为 。


