题目内容
将6.5克锌投入200mL某浓度的盐酸中,锌完全反应,反应前后溶液的体积不变。请用详细的过程,
求:
(1) 反应中生成的H2在标准状况下的体积;
(2) 取反应后的溶液20mL,加入足量的AgNO3溶液,生成白色沉淀5.74克,求原盐酸中HCl的物质的量
浓度。
求:
(1) 反应中生成的H2在标准状况下的体积;
(2) 取反应后的溶液20mL,加入足量的AgNO3溶液,生成白色沉淀5.74克,求原盐酸中HCl的物质的量
浓度。
(1)2.24L (5分)(2)先计算出20mL中AgCl的物质的量为0.04 mol,氯离子守恒,
C(HCl)= 2mol/L (5分)
C(HCl)= 2mol/L (5分)
⑴Zn+2HCl=ZnCl2+H2↑
65g 22.4L V=2.24L
6.5g V
⑵由题知AgCl的质量为5.74克,则AgCl的物质的量为5.74/143.5=0.04mol,根据氯离子守恒,20mL溶液中含Cl-0.04mol, 则200mL盐酸中含Cl-0.4mol,c(HCl)=0.4mol/0.2L=2mol/L .
65g 22.4L V=2.24L
6.5g V
⑵由题知AgCl的质量为5.74克,则AgCl的物质的量为5.74/143.5=0.04mol,根据氯离子守恒,20mL溶液中含Cl-0.04mol, 则200mL盐酸中含Cl-0.4mol,c(HCl)=0.4mol/0.2L=2mol/L .

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
 表示阿伏加德罗常数,则下列叙述正确的是
表示阿伏加德罗常数,则下列叙述正确的是 四氯化碳含有
四氯化碳含有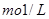 的醋酸溶液中含有
的醋酸溶液中含有  离子
离子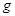 甲烷含有10
甲烷含有10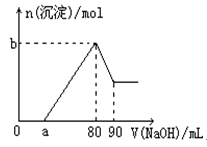
 :10
:10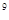
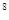
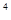 :10
:10