题目内容
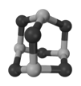
【题目】超分子化学已逐渐扩展到化学的各个分支,还扩展到生命科学和物理学等领域。由Mo将2个C60分子、2个p-甲酸丁酯吡啶及2个CO分子利用配位键自组装的超分子结构如图所示。

(1)Mo处于第五周期第VIB族,核外电子排布与Cr相似,它的基态价电子排布式是___________;核外未成对电子数是___________个。
(2)该超分子中存在的化学键类型有___________。
A σ键 B π键 C 离子键 D 氢键
(3)该超分子中配体CO提供孤电子对的原子是___________(填元素符号),p-甲酸丁酯吡啶配体中C原子的杂化方式有___________。
(4)从电负性角度解释CF3COOH的酸性强于CH3COOH的原因___________。
(5)C60与金刚石互为同素异形体,从结构与性质之间的关系解释C60的熔点远低于金刚石的原因是___________。
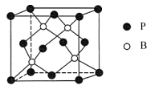
(6)已知:某晶胞中各原子的相对位置可用如图所示的原子坐标表示,其中所有顶点原子坐标均为(0,0,0)。

钼(Mo)的一种立方晶系的晶体结构中,每个晶胞有2个Mo原子,其中Mo原子坐标是(0,0,0)及(1/2,1/2,1/2)。根据以上信息,推断该晶体的原子堆积方式是___________。已知该晶体的密度是ρg·cm-3,Mo的摩尔质量是M g·mol-1,阿伏加德罗常数是NA,晶体中距离最近的Mo原子核之间的距离为___________pm。
【答案】4d55s1 6 AB C sp2和sp3 F的电负性强于H,对电子的吸引能力强,使共用电子对偏向F,使氧氢键较易断裂,因此酸性强于CH3COOH C60是分子晶体,金刚石是原子晶体,原子晶体熔化时破坏的共价键所需的能量远高于分子晶体熔化时破坏的分子间作用力 体心立方堆积 ![]()
【解析】
(1)Cr的基态价电子分布为3d54s1,而Mo与Cr同主族,但比Cr多了一周期,因而基态价电子分布为4d55s1,用轨道电子排布表示为 ,因而核外未成对的电子为6个。
,因而核外未成对的电子为6个。
(2)观察该超分子结构有双键,说明有σ键和π键,分子中不存在离子键,根据信息Mo形成配位键,因而答案选AB。
(3)CO做配体时是C做配位原子,氧把孤对电子给了碳,碳变成富电子中心,有提供电子对形成配位键的能力,p-甲酸丁酯吡啶中碳原子有形成双键,说明其杂化方式为sp2,在丁基中C原子形成四个单键为sp3杂化。
(4)F的电负性强于H,对电子的吸引能力强,使共用电子对偏向F,使氧氢键较易断裂,因此CF3COOH酸性强于CH3COOH。
(5)根据不同晶体类型的性质不同来解释:C60是分子晶体,金刚石是原子晶体,原子晶体熔化时破坏的共价键所需的能量远高于分子晶体熔化时破坏的分子间作用力。
(6)Mo的一种立方晶系的晶体结构中,以(0,0,0)Mo原子为中心,那么与之最近的Mo原子有8个,分别是(1/2,1/2,1/2),(-1/2,1/2,1/2),(1/2,-1/2,1/2)等等,因而为体心立方堆积,先计算出立方的边长,因而每个晶胞中含有2个Mo原子,晶胞体积V=![]() m3,所以立方边长a=
m3,所以立方边长a=![]() =
=![]() m,最近的两个原子坐标为(0,0,0)和(1/2,1/2,1/2),可知该立方边长为1,用距离公式算出两原子相距
m,最近的两个原子坐标为(0,0,0)和(1/2,1/2,1/2),可知该立方边长为1,用距离公式算出两原子相距![]() ,根据比例关系,原子最近真实距离等于
,根据比例关系,原子最近真实距离等于![]() ×
×![]() ×1010pm。
×1010pm。