��Ŀ����
����Ŀ��������Ƿdz���Ҫ�Ļ�ѧԭ�ϣ���Ҫ����������������˿���ٺϽ������Ʒ������ұ�������У����������Ƽ��������Ƽ�����Һ�еõ�����ơ�������Ӧ��
����WO42��(aq)+Ca(OH)2(s) ![]() CaWO4(s)+2OH��(aq) K1
CaWO4(s)+2OH��(aq) K1
��֪����Ӧ����ƽ�ⳣ��K1����ֵ���±�����ش��������⣺
�¶�/�� | 25 | 50 | 90 | 100 |
K1 | 79.96 | 208.06 | 222.88 | 258.05 |
��1���жϷ�Ӧ���ġ�S ______0����H______0�������������������������______����ϸߡ��ϵ͡����¶��������ڸ÷�Ӧ�Է�������
��2���������ƺ�����ƣ�CaWO4�������ܵ���ʣ��ܽ�Ⱦ����¶����߶���С��������ˮ�д������³����ܽ�ƽ�⣺
����CaWO4(s)![]() Ca2+(aq) + WO42��(aq) K2
Ca2+(aq) + WO42��(aq) K2
����Ca(OH)2(s)![]() Ca2+(aq) + 2OH��(aq) K3
Ca2+(aq) + 2OH��(aq) K3
�ٸ��ݷ�Ӧ�����������Ƶ���K1��K2��K3֮��Ĺ�ϵ����K1=______����K2��K3��ʾ����
�ڸ��ݷ�Ӧ������ͼΪ��ͬ�¶���CaWO4�ij����ܽ�ƽ�����ߡ���T1 ____T2���������=����������T1ʱ����0.5 molL��1�����Ƶļ�����Һ�У���������Ca(OH)2����Ӧ�ﵽƽ���WO42����ת����Ϊ60%����ʱ��Һ��c(Ca2+)=_______molL��1�������跴Ӧǰ��������䣩

��3����ȡ�����ʱ����ʱ��Ӧ���Һ������������ij���������ʣ����������WO42����ת���ʡ���Ӧ����ˣ�������Һ��ͨCO2����һ�������õ�Na2CO3��
���ڷ�Ӧ���Һ�в�ֱ��ͨ��CO2����������_____________��
����ƽ���ƶ�ԭ�����������������ʵ�����______________��
���𰸡� �� �� �ϸ� K1= K3 / K2 �� 5��10��10 ����������CO2��Ca2+����������CaCO3������WO42����ת���� ��������������OH����Ӧ��ʹ��Һ��OH��Ũ�ȼ�С��ƽ��������CaWO4�ķ����ƶ�
����������1���ɱ������ݿ�֪���¶����ߣ�Kֵ����ƽ�������ƶ���������Ӧ�����ȷ�Ӧ����H��0���ɷ���ʽ����״̬�жϣ�����Ӧ��һ�������ķ�Ӧ����Һ���������ı仯������S ��0����Ϸ�Ӧ�����оݣ�Ӧ�ڸ����������ڴ˷�Ӧ��������С�
�ٸ��ݷ�Ӧ���Ƶ���K1��K2��K3֮��Ĺ�ϵ����K1=______����K2��K3��ʾ����
��2����WO42��(aq)+Ca(OH)2(s) ![]() CaWO4(s)+2OH��(aq) K1
CaWO4(s)+2OH��(aq) K1
��CaWO4(s)![]() Ca2+(aq) + WO42��(aq) K2
Ca2+(aq) + WO42��(aq) K2
��Ca(OH)2(s)![]() Ca2+(aq) + 2OH��(aq) K3
Ca2+(aq) + 2OH��(aq) K3
�ۡ���=�٣���K1= K3/ K2��
����CaWO4(s)�ܽ�����¶����߶���С����ͼ�п�֪T1��Ksp����T2��Ksp����T1 �� T2��T1ʱ��ksp[CaWO4(s)]=10��10��T1ʱ����0.5 molL��1�����Ƶļ�����Һ�У���������Ca(OH)2����Ӧ�ﵽƽ��CaWO4(s)��WO42����ת����Ϊ60%��WO42-��aq����ƽ��Ũ��Ϊ0.2mol/L��c(Ca2+)c(WO42-)10��10��c(Ca2+)=5��10��10molL��1��
��3���ڼ��������£�CO2��Ӧ����������Һ��̼�������Ũ�ȣ�����Ca2+����������CaCO3���Ӷ�����WO42����ת���� ����������������OH����Ӧ��ʹ��Һ��OH��Ũ�ȼ�С��ƽ��������CaWO4�ķ����ƶ���

����Ŀ��(��ǹ�ҵ���Ʊ�Na2S2O3�ķ���֮һ����Ӧԭ��Ϊ��2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2���÷�Ӧ��H��0����ij�о�С����ʵ��������Ʊ�Na2S2O3��5H2O�������¡�
![]()
��1������װ����ͼ��ʾ
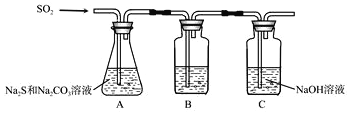
��װ��B�������Ǽ���װ��A��SO2������Ч�ʣ�B���Լ���______������SO2����Ч�ʵ͵�ʵ��������B����Һ_________��
��Ϊ��ʹSO2������������ȫ���ڲ��ı�A����ҺŨ�ȡ�����������£����˼�ʱ���跴Ӧ���⣬���ɲ�ȡ�ĺ�����ʩ��___________________������һ����
��2�����豾ʵ�����õ�Na2CO3������NaCl��NaOH�����ʵ�鷽�����м��顣����ɸ�ʵ�鷽��������֪������ʱCaCO3������Һ��pH��10.2��
��� | ʵ����� | Ԥ������ | ���� |
�� | ȡ������Ʒ���Թ��У�������������ˮ��������ܽ⣬ ______�� | �а�ɫ�������� | ��Ʒ��NaCl |
�� | ��ȡ������Ʒ���ձ��У�������������ˮ����ֽ����ܽ⣬_____�� | �а�ɫ�������ɣ��ϲ���ҺpH>10.2 | ��Ʒ��NaOH |
��3��Na2S2O3��Һ�Ƕ���ʵ���еij����Լ����ⶨ��Ũ�ȵĹ������£�
��һ����ȷ��ȡa g KIO3����ѧʽ����214�����������Һ��
�ڶ������������KI�����H2SO4��Һ���μ�ָʾ����
����������Na2S2O3��Һ�ζ����յ㣬����Na2S2O3��Һ�����ΪV mL����c(Na2S2O3)��___mol��L-1��
��4����(3)��ʵ���У�ijͬѧ��һ���͵ڶ����IJ������ܹ淶������������̫����������õ�Na2S2O3Ũ�ȿ���___________����������Ӱ��������ƫ��������ƫ��������ԭ����_____________��(�����ӷ���ʽ��ʾ)��(��֪��IO3-��5I-+6H+= 3I2��3H2O��4I-��O2+4H+=I2��2H2O��2S2O32-��I2=S4O62-��2I-)