题目内容
2.电池在生活中有着广泛的应用,依据如图装置,回答问题:
(1)图1装置中化学能不能转化为电能的原因是锌和稀硫酸直接发生化学腐蚀,不能形成闭合回路形成电流.
(2)图2装置中,电流产生的过程是锌做负极失电子发生氧化反应,铜做正极,电子从锌电极沿导线流向铜电极,溶液中氢离子得到电子发生还原反应,闭合回路中形成电流.
(3)图2装置中,在不改变电池总反应的前提下,下列替换可行的是B(填序号).
A.Zn可用Mg替换
B.Cu可用石墨、Fe替换
C.稀硫酸可用稀盐酸、稀硝酸替换
(4)图3为生活中常用的锌锰干电池的构造示意图:
①该电池的种类是A(填序号).
A.一次电池 B.二次电池(可充电) C.燃料电池
②关于该电池的性能和使用说法不正确的是C(填序号).
A.该电池可应用于手电筒、收音机等
B.该电池在使用过程中锌外壳逐渐变薄
C.该电池使用后应埋入地下,避免污染环境
③已知电池的总反应为:2MnO2+Zn+2NH4Cl→2MnO(OH)+Zn(NH3)2Cl2
电池的负极材料是Zn,正极反应产物是MnO(OH)(填化学式).
分析 (1)构成原电池需具备以下条件:两个活性不同的电极;电解质溶液;形成闭合回路;存在能自动发生的氧化还原反应,且为放热反应;
(2)图2装置中形成原电池反应,锌做负极失电子发生氧化反应,铜做正极,溶液中氢离子得到电子发生还原反应;
(3)电池总反应为Zn+H2SO4=ZnSO4+H2↑,在不改变电池总反应需要保证形成原电池反应中锌做负极;
(4)①锌锰干电池不能多次充放电;
②锌锰干电池中含有含有重金属离子,不能随意丢弃,更不能掩埋,属于一次电池,锌做电池负极被腐蚀;
③电池反应中失电子的发生氧化反应做原电池负极,得到电子发生还原反应的电极为原电池正极.
解答 解:(1)图1装置中化学能不能转化为电能的原因是锌和稀硫酸直接发生化学腐蚀,不能形成闭合回路形成电流,
故答案为:锌和稀硫酸直接发生化学腐蚀,不能形成闭合回路形成电流;
(2)图2装置中形成原电池反应,锌做负极失电子发生氧化反应,铜做正极,电子从锌电极沿导线流向铜电极,溶液中氢离子得到电子发生还原反应,闭合回路中形成电流,
故答案为:锌做负极失电子发生氧化反应,铜做正极,电子从锌电极沿导线流向铜电极,溶液中氢离子得到电子发生还原反应,闭合回路中形成电流;
(3)A.Zn用Mg替换,Mg做原电池负极,发生反应的氧化还原反应为镁和稀硫酸的反应,改变了总反应,故A错误;
B.Cu可用石墨、Fe替换,锌做负极,总反应未改变,故B正确;
C.稀硫酸可用稀盐酸替换,但不能用稀硝酸代替,稀硝酸具有强氧化性和锌反应不能生成氢气,故C错误;
故答案为:B;
(4)①锌锰干电池不能多次充放电,电池为一次电池,故选A,
故答案为:A;
②A.该电池是原电池,可应用于手电筒、收音机等的电源,故A正确;
B.该电池中锌为负极失电子发生氧化反应,在使用过程中锌外壳逐渐变薄,故B正确;
C.该电池含有重金属离子,使用后不应埋入地下,避免污染环境和土壤,故C错误;
故答案为:C;
③电池的总反应为:2MnO2+Zn+2NH4Cl→2MnO(OH)+Zn(NH3)2Cl2,锌失电子发生氧化反应,电池的负极材料是Zn,正极反应产物是MnO(OH),
故答案为:Zn;MnO(OH).
点评 本题考查了原电池原理、电极反应和电池特征分析判断、注意掌握原电池形成条件和反应原理的理解应用,题目难度中等.

| A. | 向苯酚钠溶液中通入CO2可制得苯酚,并得到碳酸钠 | |
| B. | 将铁屑、溴水、苯混合可制得溴苯 | |
| C. | 实验时不小心沾到手上的苯酚可用氢氧化钠溶液洗掉 | |
| D. | 用醋酸溶液洗涤沾附在暖水瓶内壁上水垢的过程中发生了复分解反应 |

下列叙述正确的是( )
| A. | 在NaOH水溶液中加热,化合物X可发生消去反应 | |
| B. | 在一定条件下,化合物Y可与HCHO发生缩聚反应 | |
| C. | 用FeCl3溶液不可鉴别化合物X和Y | |
| D. | 化合物Y中不含有手性碳原子 |
| A. | 常温下,水电离的c(H+)=1×10-14mol/L的溶液中:K+、Na+、AlO2-、SiO32- | |
| B. | 使甲基橙变红的溶液中:Na+、Fe3+、NO3-、SO32- | |
| C. | 常温下,在$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12的溶液中:K+、Ba2+、NO3-、I- | |
| D. | 中性的溶液中:CO32-、Na+、SO42-、AlO2- |
| A. |  利用图装置,可快速制取氨气 | |
| B. |  利用图装置,用饱和碳酸钠溶液分离CH3CH2OH和CH3COOC2H5混合液 | |
| C. |  利用图装置,可制取乙酸乙酯 | |
| D. |  利用图装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
| A. | 甲烷和苯都没有同分异构体 | |
| B. | 甲苯( )的分子中所有碳原子在同一平面上 )的分子中所有碳原子在同一平面上 | |
| C. | 苯和乙烯都能使溴水褪色,均与溴水发生加成反应 | |
| D. | 乙烯在工业上主要通过石油分馏得到 |
| A. | 将氨通入盐酸中:NH3+H+═NH4+ | |
| B. | 在NaOH溶液中滴入几滴NH4CI溶液并加热:NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 将少量铜粉放入浓硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 将稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
| A. |  用于实验室制氨气并收集干燥的氨气 | |
| B. |  用于除去CO2中含有的少量HC1 | |
| C. |  用于提取I2的CCl4溶液中的I2 | |
| D. | 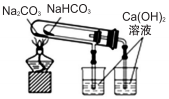 装置用于验证NaHCO3和Na2CO3的热稳定性 |
| A. | 浓度均为2×10-5mol•L-1的AgNO3溶液和NaCl溶液等体积混合,有白色沉淀产生 | |
| B. | 将0.001mol•L-1的AgNO3溶液滴入0.001mol•L-1的KCl和K2CrO4的混合溶液中,先产生AgCl沉淀 | |
| C. | c(Mg2+)为0.11mol•L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 | |
| D. | 其他条件不变,向饱和Ag2CrO4水溶液中加入少量K2CrO4溶液,溶液中c(Ag+)减小 |