题目内容
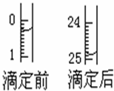 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.(1)滴定①用
②有关数据记录如下:
| 滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 25.00 | 0.50 | 25.95 | 25.45 |
| 2 | 25.00 | |||
| 3 | 25.00 | 6.00 | 31.55 | 25.55 |
(3)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果
b.读数时,若滴定前仰视,滴定后俯视,则会使测定结果
(2)先考虑数据的合理性,然后求体积的平均值,最后根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
(3)根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
(2)舍去第2组数据,求出第1组、第3组消耗的盐酸标准液的体积为:
| 25.45mL+25.55mL |
| 2 |
c(待测)=
| c(标准)×V(标准) |
| V(待测) |
| 0.1000mol/L×25.50mL |
| 25.00mL |
(3)a.若滴定前用蒸馏水冲洗锥形瓶,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
b.读数时,若滴定前仰视,滴定后俯视,造成V(标准)偏小,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |

I.某中和滴定实验过程如下:
(1)取一支用蒸馏水洗净的酸式滴定管,加入标准的盐酸溶液,记录初始读数
(2)用碱式滴定管放出一定量待测液,置于未用待测液润洗的锥形瓶中,加入酚酞2滴
(3)滴定时,边滴加边振荡,同时注视滴定管内液面的变化
(4)当滴到溶液由红色变为无色,颜色稳定后停止滴定,记录液面读数
请选出上述实验过程中的错误之处 (填序号)。
II.某烧碱溶液中含有少量杂质(不与盐酸反应),现用盐酸溶液测定其浓度。
(1)滴定:下图表示某次滴定时50 mL酸式滴定管中前后液面的位置,请将相关数据填入下表空格中。
| 滴定序号 | 待测液体积 (mL) | 所消耗盐酸体积(mL)(滴定前) | 所消耗盐酸体积(mL)(滴定后) | 所消耗盐酸体积(mL) |
| 1 | 25.00 | 0.50 | 25.12 | 24.62 |
| 2 | 25.00 |
|
|
|
| 3 | 25.00 | 6.00 | 30.58 | 24.58 |
(2)盐酸浓度为0.1000mol/L。根据所给数据,计算样品中烧碱的物质的量浓度c = 。
(3)下列几种情况所测烧碱浓度与实际浓度相比:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则测定结果 ;
b.酸式滴定管读数时,若滴定前仰视,滴定后俯视,则测定结果 ;
c.酸式滴定管中滴定前有气泡,滴定后气泡消失,则测定结果 ;
III.向25mL 0.1mol/L NaOH 溶液中加入25mL 0.2mol/L CH3COOH溶液,充分反应后
(pH<7),溶液中下列微粒:Na+,OH-,CH3COO-,H+,CH3COOH的浓度由大到小的顺序为 。
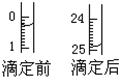
(12分)某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
(1)滴定:①用 式滴定管盛装camol/L盐酸标准液。右图
表示某次滴定时50 mL滴定管中前后液面的位置。请将用去的
标准盐酸的体积填入③表空格中。滴定管中剩余液体的体积
25.10mL(填大于、小于或者等于)。
②下表是3种常见指示剂的变色范围:
| 指示剂 | 石蕊 | 甲基橙 | 酚酞 |
| 变色范围(pH) | 5.0—8.0 | 3.1—4.4 | 8.2—10.0 |
③有关数据记录如下:
| 滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | V | 0.50 | 25.12 | 24.62 |
| 2 |  V V | | | |
| 3 | V | 6.00 | 30.58 | 24.58 |
(2)根据所给数据,写出计算烧碱样品的物质的量浓度的表达式(不必化简)
cb= 。
(3)下列几种情况会使测定结果偏高的是
a.若滴定前用蒸馏水冲洗锥形瓶;
b.读数时,若滴定前仰视,滴定后俯视;
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外;
d.若未充分振荡,刚看到溶液变色,立刻停止滴定。
 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.