题目内容
16.实验室可用NaClO3制取ClO2气体,再由ClO2制的NaClO2,实验装置如图所示:
回答下列问题:
(1)仪器a的名称为圆底烧瓶;B中H2O2发生氧化反应(填“氧化”、“还原”或“非氧化还原”);装置C的作用是防倒吸.
(2)该实验必须使NaClO3稍微过量,目的是使Na2SO3完全反应,避免产生SO2.
(3)为使ClO2气体能被均匀、充分吸收,操作时应注意控制硫酸滴入速度.
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO${\;}_{2}^{-}$,则另一种为ClO3-.
(5)证明NaClO2具有氧化性的方法是:将B中溶液加热除去H2O2,加入②(填序号,下同)酸化,再加入⑤⑥检验.
①稀HNO3 ②稀H2SO4 ③K2SO3溶液 ④BaCl2溶液 ⑤FeCl2溶液 ⑥KSCN溶液.
分析 酸性条件下,NaClO3与亚硫酸钠反应生成ClO2,ClO2与双氧水在碱性条件下反应生成NaClO2,二氧化氯属于有毒气体,所以尾气用NaOH溶液处理;
(1)根据装置图判断仪器名称;ClO2与双氧水在碱性条件下反应生成NaClO2,根据化合价的变化判断;C瓶为空的试剂瓶可以防倒吸;
(2)根据反应方程式可知使一种反应物过量,则另一种反应物反应完全;
(3)缓慢通入ClO2可以使ClO2气体能被均匀、充分吸收;
(4)根据得失电子守恒判断;
(5)酸化溶液时一般用稀硫酸,检验氧化性的物质可以选用具有还原性的物质.
解答 解:酸性条件下,NaClO3与亚硫酸钠反应生成ClO2,ClO2与双氧水在碱性条件下反应生成NaClO2,二氧化氯属于有毒气体,所以尾气用NaOH溶液处理;
(1)根据装置图可知仪器a名称为圆底烧瓶;ClO2与双氧水在碱性条件下反应生成NaClO2,反应中Cl元素的化合价降低,作氧化剂,反应中双氧水中O元素的化合价升高,双氧水作还原剂,发生氧化反应;C瓶为空的试剂瓶作为安全瓶,可以防倒吸,故答案为:圆底烧瓶;氧化;防止倒吸;
(2)根据反应方程式可知使一种反应物过量,则另一种反应物反应完全,所以该实验必须使NaClO3稍微过量,目的是使Na2SO3完全反应,避免产生SO2,故答案为:使Na2SO3完全反应,避免产生SO2;
(3)缓慢通入ClO2可以使ClO2气体能被均匀、充分吸收,硫酸、NaClO3与亚硫酸钠反应生成ClO2,所以应该控制硫酸滴入速度,故答案为:控制硫酸滴入速度;
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2-,ClO2到ClO2-化合价降低1价,则ClO2生成的另一种产物中化合价应该升高1价,所以一种为ClO3-,故答案为:ClO3-;
(5)酸化溶液时一般用稀硫酸,硝酸具氧化性,不能选用硝酸;检验氧化性的物质可以选用具有还原性的物质,所以检验NaClO2具有氧化性应该选用⑤FeCl2溶液 ⑥KSCN溶液,故答案为:②;⑤⑥.
点评 本题涉及物质的制备、氧化还原反应的分析、实验的基本操作等,考查学生理解、分析、解决问题的能力,难度较大.

| A. | 3.01×1023个CH4分子 | B. | 4℃时23.4mL H2O | ||
| C. | 23g C2H5OH | D. | 常温常压下22.4LNH3 |
| A. | 3NO2+H20═2HNO3+NO,转移3e- | |
| B. | 2KMnO4+10FeSO4+8H2SO4═K2SO4+5Fe2(SO4)3+2MnSO4+8H20,转移5e- | |
| C. | KClO3+6HCl═KCl+3Cl2↑+3H20,转移6e- | |
| D. | I2+SO2+2H20═H2SO4+2HI,转移2e- |
| A. | 3:8 | B. | 32:21 | C. | 21:32 | D. | 21:8 |
| A. | D为气体 | B. | B的转化率为80% | ||
| C. | 5min时,c(A)=1.5mol•L-1 | D. | 反应开始前A的物质的量为2mol |
| 物质的量(mol) 时间(min) | n(NH3) | n(O2) | n(H2O) |
| 0 | 2.00 | 2.25 | 0 |
| 第2min | 1.80 | 2.00 | 0.30 |
| 第4min | 1.60 | 1.75 | 0.60 |
| 第6min | 1.00 | 1.00 | 1.50 |
| 第8min | 1.00 | 1.00 | 1.50 |
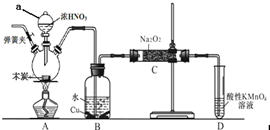 亚硝酸钠在漂白、电镀等方面应用广泛.现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略).
亚硝酸钠在漂白、电镀等方面应用广泛.现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略).