题目内容
 甲烷、甲醇、肼(N2H4)、氨和氢气等都可作为燃料电池的燃料.
甲烷、甲醇、肼(N2H4)、氨和氢气等都可作为燃料电池的燃料.(1)与甲醇互为等电子体的有机物分子式为:
(2)N2H4中N-N键键能_
(3)用钛锰储氢合金储氢,与高压氢气钢瓶相比,具有重量轻、体积小的优点.锰原子外围电子排布式为:
(2)根据原子半径越小,形成的共价键越稳固,化学键键能越大;
(CH3)2CO中甲基上的碳原子周围与4个原子相连,呈四面体结构,所以杂化方式是sp3;(CH3)2CO中羰基上的碳原子周围与3个原子相连,呈平面三角形结构,所以杂化方式是sp2;
1个(CH3)2CO中含有8个单键,1个双键,1个单键是1个σ键,1个双键中含有1个π键和1个σ键;
(3)根据电子排布式的书写方法写出锰原子电子排布式,然后再写出外围电子排布式;利用晶胞的均摊法计算:在晶胞里面的原子记为一个、在面上的原子记为1/2个、在楞上的原子记为1/4个、在顶角上的原子记为1/8个.
甲醇中含有-OH,氧元素的电负性较大,原子半径小,可以形成氢键,所以甲醇的熔、沸点比甲烷的熔、沸点高,
故答案为:CH3SH;甲醇分子之间有氢键;
(2)氮原子的半径比碳原子的半径小,形成的共价键N-N比C-C稳固,所以N2H4中N-N键键能大于CH3CH3中C-C键键能;
(CH3)2CO中甲基上的碳原子周围与4个原子相连,呈四面体结构,所以杂化方式是sp3;(CH3)2CO中羰基上的碳原子周围与3个原子相连,呈平面三角形结构,所以杂化方式是sp2;
1个(CH3)2CO中含有1个π键,所以1mol (CH3)2CO中的π键数目为:6.02×1023,
故答案为:>;sp3杂化;sp2杂化;6.02×1023;
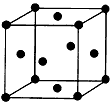
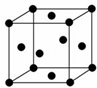
(3)Mn原子核外共25个电子,按照能量最低原则电子先填入能量最低的1s轨道,填满后再依次填入能量较高的轨道,其电子排布式为:1S22S22P63S23P63d54S2,外围电子排布式为:3d54s2;金属钛晶胞中,钛原子位于晶胞的顶点和面心位置,则晶胞中含有钛原子的数目为:8×
| 1 |
| 8 |
| 1 |
| 2 |
| 3 |
| 2 |

(11分)利用燃料和氧化剂之间发生的氧化还原反应,将化学能直接转化为电能的装置叫燃料电池,它是一种高效低污染的新型电池。燃料电池所用燃料可以是氢气,也可以是甲烷、甲醇、肼、氨等。肼分子(H2N-NH2)可以在氧气中燃烧生成氮气和水,回答下列问题:
(1)利用肼、氧气与KOH溶液组成碱性燃料电池,请写出该电池负极的电极反应式:
,并指出电解质溶液中OH-离子向 极移动。
若用该燃料电池电解饱和食盐水得C12 7.1g,则需肼 g,若想将电解后饱和食盐水恢复原状,需 。
(2)用电离方程式表示肼的水溶液呈碱性的原因 ;
(3)天然气有着来源广,污染小的优点,但未能在汽车燃料中推广应用,而其催化氧化产物甲醇却被推广使用,主要是因为 。
(4)如果将燃料改为汽油则为汽油燃料电池,该燃料电池最大的障碍是氧化反应不完全产生 堵塞电极的气体通道,有人估计,完全避免这种副反应至少还需10年时间,正是新一代化学家的历史使命。
(5)肼是强还原剂,与氧化剂H2O2反应时可放出大量的热,因此,肼可以作为火箭推进剂。
某些共价键的键能
键 | 键能/kJ?mol-1 | 键 | 键能/kJ?mol-1 | 键 | 键能/kJ?mol-1 |
N-N | 193 | N=N | 418 | N≡N | 946 |
O-O | 142 | O=O | 497 | H-H | 436 |
N-H | 391 | O-H | 463 |
|
|
根据以上信息,试写出肼与H2O2反应的热化学方程式 。