题目内容
(11分) 元素周期表反映了元素性质的周期性变化规律。请根据短周期元素在周期表中的位置、结构和相关性质,回答下列问题:
(1) 第VIA族元素形成的气态氢化物中沸点最高的是____________(用分子式表示),原因是____________________,该分子的空间构型为______________。
(2) 第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如表1所示,其中E的化学式为 ;第三周期元素单质的熔点(℃)变化如图a所示,其中h的元素符号为 。 (表1)
| 氢化物 | A | B | HF | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 |
|
|
(3) 第二、第三周期的某些元素能形成单质甲和化合物乙,它们具有图b所示的结构单元,甲和乙的晶体类型相同,甲的某种同素异形体与乙在高温时能发生置换反应生成h的单质和CO。若该反应生成的h的单质含有1 mol共价键,则参加反应的乙的质量为_______________g。
(4) 碳元素的某种单质具有平面层状结构,该单质的名称为__________;同一层中的原子构成许多的正六边形,单质与熔融的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图c所示,该物质的化学式为 。
(11分)
(1) H2O(1分) H2O分子间可以形成氢键(1分) 角型或折线型(1分)
(2) CH4(1分) Si(1分) (3) 30(2分) (4) 石墨(1分) KC8(3分)
解析:

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案(共11分)西瓜膨大剂别名氯吡苯脲,是经过国家批准的植物生长调节剂,实践证明长期使用对人体无害。已知其相关理化性质如下表所示:
| 分子式 | 结构简式 | 外观 | 熔点 | 溶解性 |
| C12H10ClN3O |
| 白色结晶粉末 | 170~172°C | 易溶于水 |
(1)氯元素基态原子核外电子的未成对电子数为 。
(2)氯吡苯脲的晶体类型为_______ ,所含第二周期元素第一电离能从大到小的顺序为__________________。
(3)氯吡苯脲晶体中,氮原子的杂化轨道类型为______ _。
(4)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲。
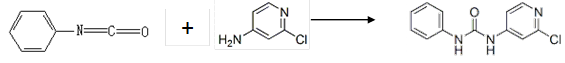
反应过程中,每生成1mol氯吡苯脲,断裂_______个σ键、断裂_______个π键
(5)波尔多液为常见杀菌剂,喷洒后生成可溶的硫酸铜溶液,加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成深蓝色透明溶液,得到配位数为4的的配合物。写出沉淀溶解的离子方程式 。
(11分,最后一空为2分,其余各1分)下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | | | | | ① | | ② | |
| 三 | ③ | ④ | ⑤ | ⑥ | | | ⑦ | ⑧ |
| 四 | ⑨ | | | | | | ⑩ | |
(2)化学性质最不活泼的元素的原子结构示意图为
(3)元素的最高价氧化物对应的水化物中酸性最强的酸是 ,碱性最强的
碱是 呈两性的氢氧化物是 ;
(4)在③~⑦元素中,原子半径最大的是 ,原子半径最小的是 ;
(5)在⑦与⑩的单质中,氧化性强的是 ,可用什么化学反应说明该事实(写出反应的化学方程式):
(11分) 元素周期表反映了元素性质的周期性变化规律。请根据短周期元素在周期表中的位置、结构和相关性质,回答下列问题:
(1) 第VIA族元素形成的气态氢化物中沸点最高的是____________(用分子式表示),原因是____________________,该分子的空间构型为______________。
(2) 第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如表1所示,其中E的化学式为 ;第三周期元素单质的熔点(℃)变化如图a所示,其中h的元素符号为 。 (表1)
|
氢化物 |
A |
B |
HF |
D |
E |
|
沸点/℃ |
1317 |
100 |
19.5 |
|
|
(3) 第二、第三周期的某些元素能形成单质甲和化合物乙,它们具有图b所示的结构单元,甲和乙的晶体类型相同,甲的某种同素异形体与乙在高温时能发生置换反应生成h的单质和CO。若该反应生成的h的单质含有1 mol共价键,则参加反应的乙的质量为_______________g。
(4) 碳元素的某种单质具有平面层状结构,该单质的名称为__________;同一层中的原子构成许多的正六边形,单质与熔融的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图c所示,该物质的化学式为 。

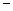 33.35
33.35
 33.35
33.35