题目内容
(10分)25℃时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因是 (用离子方程式表示);
(2)混合溶液中由水电离出的c(H+) 0.1 mol·L-1 NaOH溶液中由水电离出的c(H+)(选填“>”、“<”、或“=”)
(3)求出混合液的下列算式的精确计算结果(填具体数值):
c(Na+)-c(A-)= mol·L-1;
(4)已知NH4A溶液是中性,又知将HA溶液加入到Na2CO3溶液中有气体放出,试推断
(NH4)2CO3溶液的pH 7 (选填“>”、“<”或“=”);
(5)将相同温度下浓度相同的四种盐溶液:A.NH4HCO3、B.NH4A 、C.(NH4)2SO4、D.NH4Cl,按pH由大到小的顺序排列 (填序号)。
(1) A—+H2O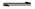 HA+OH— (2) >
HA+OH— (2) >
(3) 9.9×10-7或10-6—10-8 都对 (4) > (5) A> B> D> C
解析

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目