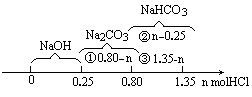题目内容
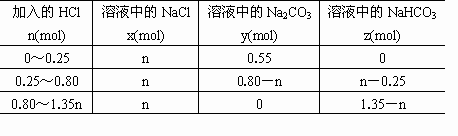
取0.45mol NaOH、0.35mol Na2CO3和0.20mol NaHCO3溶解于水,该混合液中逐渐加入盐酸,反应明显分三个段进行.若加入的HCl为n mol,溶液中NaCl、Na2CO3、NaHCO3分别为x mol、y mol、z mol,试分别计算在n值增大的过程中,不同反应阶段的n值范围和所对应的x、y、z值.将其结果填入下表.(提示:Na2CO3+HCl![]() NaHCO3+NaCl,NaHCO3+HCl
NaHCO3+NaCl,NaHCO3+HCl![]() NaCl+H2O+CO2↑)
NaCl+H2O+CO2↑)
答案:
解析:
解析:
|
分析: 当三种物质溶于水,立即发生如下的反应: NaOH+NaHCO3 三种物质,物质的量将发生如下变化: NaOH 0.45-0.20=0.25(mol) NaHCO3 0.20-0.20=0 Na2CO3 0.35+0.20=0.55(mol) 当向溶液中逐步加入盐酸时,反应明显分三步进行: (1)NaOH+HCl (2)Na2CO3+HCl (3)NaHCO3+HCl 由反应可知消耗HCl的量就是生成NaCl的量(Cl元素守恒).溶液中NaOH、Na2CO3、NaHCO3的量随HCl物质的量n mol改变而变化.
|

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目