题目内容
200°C时,11.6克C02和水蒸气的混合气体与足量的Na2O2充分反应后,固体的质量增加了 3. 6克。从以上信息中,我们得出的下列结论中不正确的是
| A.可以计算出混合气体中CO2和水蒸气的质量 |
| B.可以判断出混合气体的平均摩尔质量 |
| C.可以计算出该反应中转移的电子数 |
| D.可以总结出Na2O2任何反应中既作氧化剂也作还原剂 |
D
解析答案:D
A、正确
设CO2 ag ,水蒸气bg
2CO2 + 2Na2O2 = 2Na2CO3 + O2 m(质量差)
88 56
a x
x=7a/11g
2Na2O2+2H2O =4NaOH+O2 m(质量差)
=4NaOH+O2 m(质量差)
36 4
b y
y=b/9g
a+b=11.6
7a/11+b/9=3.6
a=4.4g
b=7.2g
n(CO2)=4.4/44=0.1mol
n(H2O)=7.2/18=0.4mol
CO2和H2O的物质的量比=0.1:0.4=1:4
所以,可以计算出混合气体中CO2和水蒸气的质量分别是4.4g和7.2g
B、正确,可以判断出混合气体的平均摩尔质量(4.4g+7.2g)÷(0.1mol+0.4mol)=23.2g/mol;
C、正确,可以计算出该反应中转移的电子数0.1mol+0.4mol=0.5mol;
D、不正确,Na2O2中-1价的氧既可升高,也可降低。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
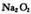 充分反应后,固体的质量增加了 3. 6克。从以上信息中,我们得出的下列结论中不正确的是
充分反应后,固体的质量增加了 3. 6克。从以上信息中,我们得出的下列结论中不正确的是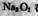 t任何反应中既作氧化剂也作还原剂
t任何反应中既作氧化剂也作还原剂