题目内容
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:
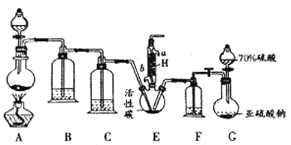
已知:①SO2(g) + Cl2(g)=SO2Cl2(l); △H=-97.3 kJ·mol-1
② 硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;
③硫酰氯在100℃以上或被长时间存放都易分解,生成二氧化硫和氯气
回答下列问题:
(1)硫酰氯在潮湿空气中“发烟”的原因是________________(用化学方程式表示)。
(2)检验装置G的气密性的方法是_________________________。
(3)装置A中发生反应的离子方程式为_________________________。
(4)H的作用是____________其中水流的方向是_____进________出(填“a”或“b”)
(5)装置C、F中的试剂相同,盛放的试剂为____________________。
(6)该装置存在的一处缺陷是____________________。
(7)若将SO2、Cl2按照一定比例通入水中,请设计简单实验验证二者是否恰好完全反应(简要描述实验步骤、现象和结论)________________仪器自选,供选择试剂:滴加酚酞的氢氧化钠溶液、氯化亚铁溶液、硫氰化钾溶液、品红溶液。
【答案】SO2Cl2+2H2O ===H2SO4+2HCl 用止水夹夹住导气橡皮管,从分液漏斗向烧瓶中注入水,一段时间后,分液漏斗中液面不下降,则说明气密性良好 MnO2+4H++2Cl![]() Mn2++2H2O+Cl2↑ 冷凝回流 b a 浓硫酸 缺少尾气处理装置 取少量溶液,向其中加入品红溶液,若品红不褪色,说明二者恰好完全反应
Mn2++2H2O+Cl2↑ 冷凝回流 b a 浓硫酸 缺少尾气处理装置 取少量溶液,向其中加入品红溶液,若品红不褪色,说明二者恰好完全反应
【解析】
(1)硫酰氯在潮湿空气中与水发生反应产生易溶于水的氯化氢,遇水蒸气而“发烟”,发生的反应为SO2Cl2+2H2O ===H2SO4+2HCl;(2)检验装置G的气密性的方法是用止水夹夹住导气橡皮管,从分液漏斗向烧瓶中注入水,一段时间后,分液漏斗中液面不下降,则说明气密性良好;(3)装置A中利用二氧化锰和浓盐酸在加热条件下反应生成氯化锰、氯气和水,发生反应的离子方程式为MnO2+4H++2Cl![]() Mn2++2H2O+Cl2↑;(4)H的作用是冷凝回流,其中水流的方向是b进a出;(5)装置C、F中的试剂相同,均为防止产生的硫酰氯遇水水解且可控制气流速率,盛放的试剂为浓硫酸;(6)二氧化硫及氯气均为污染性的气体,直接排放会污染空气,故该装置存在的一处缺陷是缺少尾气处理装置;(7)若将SO2、Cl2按照一定比例通入水中,若完全反应则生成硫酸和盐酸均无漂白性,故可设计如下实验验证:取少量溶液,向其中加入品红溶液,若品红不褪色,说明二者恰好完全反应。
Mn2++2H2O+Cl2↑;(4)H的作用是冷凝回流,其中水流的方向是b进a出;(5)装置C、F中的试剂相同,均为防止产生的硫酰氯遇水水解且可控制气流速率,盛放的试剂为浓硫酸;(6)二氧化硫及氯气均为污染性的气体,直接排放会污染空气,故该装置存在的一处缺陷是缺少尾气处理装置;(7)若将SO2、Cl2按照一定比例通入水中,若完全反应则生成硫酸和盐酸均无漂白性,故可设计如下实验验证:取少量溶液,向其中加入品红溶液,若品红不褪色,说明二者恰好完全反应。

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案