题目内容
信息时代产生的大量电子垃圾对环境构成了威胁.某研究性学习小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:

(1)第①步Cu与酸反应的离子方程式为______.
(2)第②步加H2O2的作用是______.
(3)该探究小组提出两种方案测定CuSO4?5H2O晶体的纯度.
方案一:取a g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.100 0mol?L-1Na2S2O3标准溶液滴定(原理为I2+2S2O2-═2I-+S4O2-),到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①滴定过程中可选用______作指示剂,滴定终点的现象是______.
②CuSO4溶液与KI反应的离子方程式为______.
方案二:取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用c mol?L-1 EDTA(H2Y2- )标准溶液滴定至终点,平均消耗EDTA溶液6mL.滴定反应如下:Cu2++H2Y2-═CuY2-+2H+.
③写出计算CuSO4?5H2O质量分数的表达式w=______.
④下列操作会导致CuSO4?5H2O含量的测定结果偏高的是______(填字母).
a.未干燥锥形瓶 b.滴定终点时滴定管尖嘴中产生气泡 c.未除净可与EDTA反应的干扰离子.
解:(1)Cu和浓HNO3的离子反应为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;故答案为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
(2)双氧水作氧化剂把Fe2+氧化为Fe3+;故答案为:把Fe2+氧化为Fe3+;
(3)①有碘参加反应,因此可以选用淀粉溶液作指示剂,根据滴定终点的判断方法,要求蓝色刚好褪去,且半分钟内不恢复蓝色;故答案为:淀粉溶液、蓝色刚好褪去,且半分钟内不恢复蓝色;
②铜离子被I-还原为亚铜离子,碘离子被氧化为I2,根据原子守恒和得失电子守恒书写离子方程式为;2Cu2++4I-═2CuI↓+I2;故答案为:2Cu2++4I-═2CuI↓+I2;
③根据方程式可知20.00mL溶液中n(CuSO4?5H2O)=n(EDTA)=c×6×10-3mol;所以m(CuSO4?5H2O)=c×6×10-3mol×250g/mol=1.5c g,因此100mL溶液中CuSO4?5H2O的质量为:1.5c×5=7.5cg,所以w= ×100%,故答案为:
×100%,故答案为: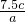 ×100%;
×100%;
④根据CuSO4?5H2O质量分数的表达式: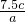 ×100% 分析;
×100% 分析;
a.未干燥锥形瓶,对滴定无影响;
b.滴定终点时滴定管尖嘴中产生气泡,读数时标准溶液体积偏小,结果偏小;
c.未除净可与EDTA反应的干扰离子,导致消耗的EDTA偏多,计算结果偏大,
故答案为:c;
分析:(1)Cu和浓HNO3的离子反应
(2)双氧水作氧化剂把Fe2+氧化为Fe3+
(3)有碘参加反应,因此可以选用淀粉溶液作指示剂,根据滴定终点的判断方法分析;
(4)铜离子被I-还原为亚铜离子,根据原子守恒和得失电子守恒书写;
(5)根据方程式计算;
点评:本题考查了金属与强氧化性酸的反应,中和滴定实验,氧化还原反应,根据方程式的计算等,综合性较强.
(2)双氧水作氧化剂把Fe2+氧化为Fe3+;故答案为:把Fe2+氧化为Fe3+;
(3)①有碘参加反应,因此可以选用淀粉溶液作指示剂,根据滴定终点的判断方法,要求蓝色刚好褪去,且半分钟内不恢复蓝色;故答案为:淀粉溶液、蓝色刚好褪去,且半分钟内不恢复蓝色;
②铜离子被I-还原为亚铜离子,碘离子被氧化为I2,根据原子守恒和得失电子守恒书写离子方程式为;2Cu2++4I-═2CuI↓+I2;故答案为:2Cu2++4I-═2CuI↓+I2;
③根据方程式可知20.00mL溶液中n(CuSO4?5H2O)=n(EDTA)=c×6×10-3mol;所以m(CuSO4?5H2O)=c×6×10-3mol×250g/mol=1.5c g,因此100mL溶液中CuSO4?5H2O的质量为:1.5c×5=7.5cg,所以w=
 ×100%,故答案为:
×100%,故答案为: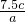 ×100%;
×100%;④根据CuSO4?5H2O质量分数的表达式:
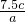 ×100% 分析;
×100% 分析;a.未干燥锥形瓶,对滴定无影响;
b.滴定终点时滴定管尖嘴中产生气泡,读数时标准溶液体积偏小,结果偏小;
c.未除净可与EDTA反应的干扰离子,导致消耗的EDTA偏多,计算结果偏大,
故答案为:c;
分析:(1)Cu和浓HNO3的离子反应
(2)双氧水作氧化剂把Fe2+氧化为Fe3+
(3)有碘参加反应,因此可以选用淀粉溶液作指示剂,根据滴定终点的判断方法分析;
(4)铜离子被I-还原为亚铜离子,根据原子守恒和得失电子守恒书写;
(5)根据方程式计算;
点评:本题考查了金属与强氧化性酸的反应,中和滴定实验,氧化还原反应,根据方程式的计算等,综合性较强.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
下列各组物质中,气体X和气体Y在通常条件下同时通入盛有溶液Z的洗气瓶中(如图所示),一定没有沉淀生成的是
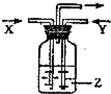
| X | Y | Z | |
| A | N02 | S02 | BaCl2 |
| B | NH3 | 02 | Al2(S04)3 |
| C | NH3 | C02 | NaCl(饱和) |
| D | CO | 02 | Ca(OH)2 |
- A.A
- B.B
- C.C
- D.D
A、B、C、D、E均为可溶于水的固体,组成它们的离子有:
| 阳离子 | Na+、Mg2+、Al3+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、SO42-、HSO4- |
①A溶液与B溶液反应生成白色沉淀和无色气体,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,
但不消失.
请回答:
(1)写出物质的化学式:B______,D______.
(2)写出相应的离子方程式:
Ⅰ、A溶液与C溶液反应:______.
Ⅱ、A溶液与少量E反应:______.
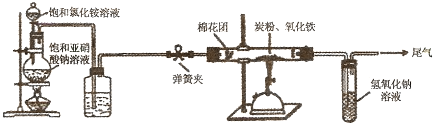

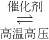 2NH3,5min后达到平衡,平衡时氨的体积分数为25%.
2NH3,5min后达到平衡,平衡时氨的体积分数为25%. 2H2↑+O2↑
2H2↑+O2↑