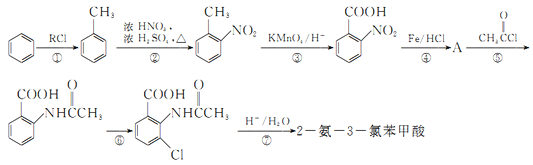
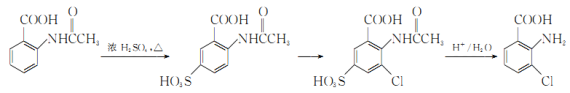��Ŀ����
����Ŀ���Ҷ���(![]() )�������ᣬ���������һ�ִ�л������������ʵ��̽������ֽⷴӦ�IJ��
)�������ᣬ���������һ�ִ�л������������ʵ��̽������ֽⷴӦ�IJ��
���ϲ��ģ�
��.�����۵�Ϊ102�棬150~160��������157��ʱ��ʼ�ֽ⡣��������C2O42��������������γɲ���Ƶ�������ʯ��
��.PdCl2��Һ�����ڼ���CO����Ӧ�Ļ�ѧ����ʽΪCO+PdCl2+H2O====CO2+2HCl+Pd(��ɫ��ĩ)��
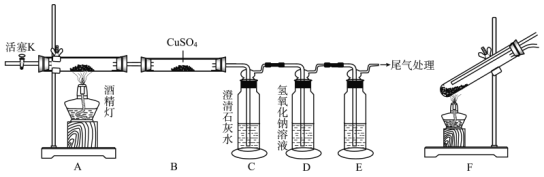
(1)A��ʢ�Ų���IJ���������������_____________��ʵ���й۲쵽B��CuSO4��ĩ��������ػ�ѧ����ʽΪ_____________��
(2)װ��E�е��Լ�Ϊ_____________�����۲쵽_____________(������)������֤����CO����������
(3)�����Ǹ�ʵ������е���ز�������ȷ�IJ���˳��Ϊ_________(�������в������ĸ)��
A.��װ����ͨ������N2 B.��ȼ�ƾ��� C.���װ��������
D.װ������Լ� E.�ٴ�ͨ��N2��Ϩ��ƾ���
(4)Ϊȷ֤�bA��CO2�����������ȡ����C�г������Թ��У��μӹ������Ტ�۲��Ƿ������ݲ�������Ŀ����_____________������ֽⷴӦ�Ļ�ѧ����ʽΪ_____________��
(5)ʵ������У�ѧ�����װ��AӦ��Ϊװ��F��������Ϣ������ԭ����_____________����������ĩ�����۾��Ӧ����_____________��Ȼ���ҽ��
���𰸡�Ӳ�ʲ����� CuSO4+5H2O= CuSO4 5H2O PdCl2��Һ ��ɫ���������ɫ��ĩ�� CDABE �ų����������Զ�����̼�ļ���������� H2C2O4 ![]() H2O+CO��+CO2�� �����ڷֽ�ǰ�Ѿ��ۻ����øĽ����Ա���Һ̬��������Ӳ�ʲ����� �ô�����ˮ����������ˮ����ϴ
H2O+CO��+CO2�� �����ڷֽ�ǰ�Ѿ��ۻ����øĽ����Ա���Һ̬��������Ӳ�ʲ����� �ô�����ˮ����������ˮ����ϴ
��������
����װ��ͼ��֪��װ��A��Ӳ�ʲ�������ʢ�Ų��ᣬ�������ȷֽ����ɶ�����̼��һ����̼��ˮ��ע�����ֽ�ǰ�Ѿ��ۻ���Һ̬������ܻ�����Ӳ�ʲ�����Ӱ��ʵ�飻װ��B�г���ʯ��ˮ���Լ��������̼���������ӷ����IJ�����������Ŷ�����̼�ļ��飻װ��D������������Һ�������ն�����̼��װ��E��PdCl2��Һ�����ڼ���CO��
��1��A��ʢ�Ų���IJ���������Ӳ�ʲ�������ʵ���й۲쵽B��CuSO4��ĩ����˵������ֽ���ˮ���ɣ�CuSO4��ĩ�����Ļ�ѧ����ʽΪ��CuSO4+5H2O= CuSO4 5H2O���ʴ�Ϊ��Ӳ�ʲ�������CuSO4+5H2O= CuSO4 5H2O��
��2��װ��E��Ŀ���Ǽ��鷴Ӧ���ɵ�һ����̼��������Ϣ���֪������PdCl2��Һ�����ڼ���CO��CO���ڵ�ʵ���������к�ɫ���������ɫ��ĩ�����ɣ��ʴ�Ϊ��PdCl2��Һ����ɫ���������ɫ��ĩ����
��3��ʵ�鿪ʼǰ���װ�������ԣ����װ�������Ժ�װ������Լ���Ϊ��ֹ�����ж�����̼���Ŷ�����̼�ļ��飬��ȼ�ƾ���ǰӦ����װ����ͨ������N2���ų������ж�����̼��ʵ��ĸ��ţ�Ϩ��ƾ���ǰӦ������װ����ͨ������N2�ų�CO���Է���Ⱦ�������ʴ�Ϊ��CDABE��
��4��������157��ʱ��ʼ�ֽ����ɶ�����̼��һ����̼��ˮ����Ӧ�Ļ�ѧ����ʽΪH2C2O4 ![]() H2O+CO��+CO2�������ڲ�����150~160��ʱ�����������Էֽ�Ļ�������л���в�������������������ʯ��ˮ��Ӧ���ɲ���Ƴ�����Ϊȷ֤�b��CO2���������Ӧ������м�������۲��Ƿ������ݲ������ʴ�Ϊ���ų����������Զ�����̼�ļ���������ţ�H2C2O4
H2O+CO��+CO2�������ڲ�����150~160��ʱ�����������Էֽ�Ļ�������л���в�������������������ʯ��ˮ��Ӧ���ɲ���Ƴ�����Ϊȷ֤�b��CO2���������Ӧ������м�������۲��Ƿ������ݲ������ʴ�Ϊ���ų����������Զ�����̼�ļ���������ţ�H2C2O4 ![]() H2O+CO��+CO2����
H2O+CO��+CO2����
��5��ʵ������У�����ֽ�ǰ�Ѿ��ۻ���Һ̬������ܻ�����Ӳ�ʲ�����Ӱ��ʵ�飬������ý�װ��A��Ϊװ��F��������Һ�����ԣ���������ĩ�����۾������۾������̼����ã�Ӧ�����ô�����ˮ����������ˮ����ϴ��Ȼ���ҽ���ʴ�Ϊ�������ڷֽ�ǰ�Ѿ��ۻ����øĽ����Ա���Һ̬��������Ӳ�ʲ����ܣ��ô�����ˮ����������ˮ����ϴ��

����Ŀ���ϳ����������о�����Ҫ������Ŀǰ��ҵ�ϳɰ���ԭ��Ϊ��N2(g) + 3H2(g) 2NH3(g) ��H=-93.0kJ/mol
��1��ij�¶��£���2 L�ܱ������з���������Ӧ�������������
ʱ��/h ���ʵ���/mol | 0 | 1 | 2 | 3 | 4 |
N2 | 2.0 | 1.83 | 1.7 | 1.6 | 1.6 |
H2 | 6.0 | 5.49 | 5.1 | 4.8 | 4.8 |
NH3 | 0 | 0.34 | 0.6 | 0.8 | 0.8 |
��0~2 h�ڣ�v(N2)=____________��
��ƽ��ʱ��H2��ת����Ϊ____�����¶��£���Ӧ2NH3(g)N2(g) + 3H2(g) ��ƽ�ⳣ��K=___(mol/L)2��
���������¶Ⱥ�������䣬��ʼͶ���N2��H2��NH3�����ʵ����ֱ�Ϊa mol��b mol��c mol���ﵽƽ���NH3��Ũ�����ϱ�����ͬ��Ϊ_______(��ѡ����ĸ)��
A��a=l��b=3��c=0 B��a=4��b=12��c=0
C��a=0��b=0��c=4 D��a=l��b=3��c=2
��2�����ݱ��������¡���ѹ�£�N2�ڲ��������������Ķ������Ѵ�����������ˮ������Ӧ������NH3��O2����֪��H2��ȼ������H=-286.0kJ/mol������N2��ˮ��Ӧ��NH3���Ȼ�ѧ����ʽΪ________________________________��