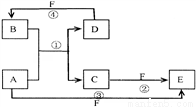
题目内容
某元素的同位素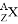 ,它的氯化物XCl2 1.11 g溶于水制成溶液后,加入1 mol/L的AgNO3溶液20 mL恰好完全反应。若这种同位素原子核内有20个中子,求:
,它的氯化物XCl2 1.11 g溶于水制成溶液后,加入1 mol/L的AgNO3溶液20 mL恰好完全反应。若这种同位素原子核内有20个中子,求:
(1)Z值和A值__________;
(2)X元素在周期表中的位置__________;
(3)把X的单质放入水中,有何现象?__________,写出反应的化学方程式__________。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 第三周期元素的简单离子中半径最小 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是____________(用元素符号表示)元素Z的离子结构示意图为_________________。
(2)金属镁可以在元素X的最高价氧化物中燃烧的化学方程式:______________
(3)元素Y的与氢元素形成一种离子YH4+,写出其电子式_________________。
(4)写出Z元素最高价氧化物与NaOH溶液反应的离子方程式:_______________。
(5)元素X与元素Y相比,非金属性较强的是______(用元素符号表示)。下列表述中证明这一事实的是____________。
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物水化物的酸性比X的最高价氧化物水化物的酸性强
c.X与Y形成的化合物中X元素呈正价态
(6)探寻物质的性质差异性是学习的重要方法之一。X、Y、Z三种元素的单质中化学性质明显不同于其他两种单质是___________(用元素符号表示),理由_________。


 Na2CO3+H2O+CO2↑,实验室模拟该过程包括制备NH3、制取NaHCO3、分离及灼烧NaHCO3四个步骤,下列图示装置能达到实验目的的是
Na2CO3+H2O+CO2↑,实验室模拟该过程包括制备NH3、制取NaHCO3、分离及灼烧NaHCO3四个步骤,下列图示装置能达到实验目的的是 B. 制取NaHCO3
B. 制取NaHCO3 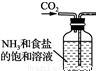
 D. 灼烧NaHCO3
D. 灼烧NaHCO3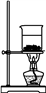
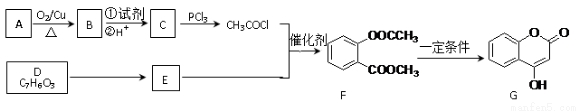
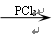 RCOCl;D与FeCl3溶液能发生显色。
RCOCl;D与FeCl3溶液能发生显色。 )是一种重要的有机合成中间体。试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)。注:合成路线的书写格式参照如下示例流程图:_________________
)是一种重要的有机合成中间体。试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)。注:合成路线的书写格式参照如下示例流程图:_________________ CH3COOH
CH3COOH CH3COOCH2CH3
CH3COOCH2CH3