题目内容
4.下列表示对应化学反应的离子方程式.其中正确的是( )| A. | 氧化铁溶于过量氢碘酸溶液中:Fe2O3+6H++2I-═2Fe2++I2+3H2O | |
| B. | NH4HCO3溶液中加入过量氢氧化钠溶液:NH4++OH-═NH3.H2O | |
| C. | 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H20═HClO+HSO3- | |
| D. | 0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合:Al3++2SO42-+2Ba++4OH-═2BaSO4↓+AlO2-+2H2O |
分析 A.金属氧化物能溶于酸,三价铁具有氧化性能氧化碘离子;
B.NH4HCO3与过量NaOH溶液混合生成一水合氨、碳酸钠和水;
C.二氧化硫足量,次氯酸根离子与二氧化硫发生氧化还原反应,次氯酸根离子完全转化成氯离子;
D.0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合,生成硫酸钡、氢氧化铝和一水合氨.
解答 解:A.氧化铁可溶于氢碘酸,三价铁具有氧化性能氧化碘离子,反应的离子方程式为:Fe2O3+2I-+6H+=2Fe2++3H2O+I2,故A正确;
B.NH4HCO3与过量NaOH溶液混合生成一水合氨、碳酸钠和水,离子方程式为:NH4++HCO3-+2OH-═NH3•H2O+CO32-+H2O,故B错误;
C.向次氯酸钠溶液中通入足量二氧化硫气体,次氯酸根离子能够氧化二氧化硫,次氯酸根离子完全转化成氯离子,正确的离子方程式为:ClO-+H2O+SO2═SO42-+2H++Cl-,故C错误;
D.氨水为弱碱不能溶解氢氧化铝,0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合生成硫酸钡、氢氧化铝和一水合氨,离子反应为Al3++NH4++4OH-+SO42-+Ba2+=BaSO4↓+NH3?H2O+Al(OH)3↓,故D错误;
故选A.
点评 本题考查氧化还原反应、离子反应,侧重于学生的分析能力的考查,注意把握氧化还原反应的特征和规律,从元素化合价的角度认识相关概念,题目难度中等.

练习册系列答案
相关题目
14.用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A. | 标准状况下,22.4 L CO2含有2NA个氧原子 | |
| B. | 1 mol•L-1 NaOH溶液中含有NA个Na+ | |
| C. | 标准状况下,22.4L CCl4中含有NA个CCl4分子 | |
| D. | 常温常压下,28g氮气所占的体积为22.4 L |
15. 如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )
如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )
 如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )
如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )| A. | 2:7 | B. | 5:4 | C. | 4:5 | D. | 7:3 |
12.工业废水需处理达标后才能排放.下列废水处理的方法合理的是( )
| A. | 用中和法除去废水中的酸 | B. | 用混凝剂除去废水中的重金属离子 | ||
| C. | 用氯气除去废水中的悬浮物 | D. | 用臭氧除去废水中的异味 |
19.下列关于燃烧热的说法中正确的是 ( )
| A. | 在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 | |
| B. | 常温下,可燃物燃烧放出的热量 | |
| C. | 在25℃、1.01×105Pa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量 | |
| D. | 燃烧热随化学方程式前的化学计量数的改变而改变 |
9.研究发现,硝酸越稀,还原产物中氮元素的化合价越低.某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出.在反应结束后的溶液中,逐滴加入4mol/L NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列说法不正确的是( )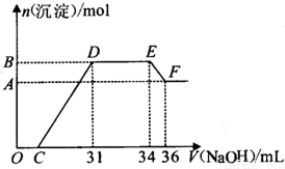

| A. | OC段离子反应方程式为H++OH-═H2O | |
| B. | 溶液中n(NH${\;}_{4}^{+}$)=0.012 mol | |
| C. | 溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+ | |
| D. | 欲测定F点沉淀的质量,实验步骤是:过滤、洗涤、干燥、称量 |
14.氯化铁溶液与氢氧化铁胶体具有的共同性质是( )
| A. | 两者的本质区别是氢氧化铁胶体能产生丁达尔现象 | |
| B. | 都能透过半透膜 | |
| C. | 都是透明的澄清液体 | |
| D. | 都呈红褐色 |
 尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)
尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)